
题目列表(包括答案和解析)
2.(16分)
(1) NO (g)+2CO(g)=N2(g)+2CO2(g) △H=-746.5 kJ/mol 3分
(2)①结论一: NO转化效率比NO2 的低 3分
结论二:在250°C -450°C时,NOx转化率随温度升高而增大,450°C -600°C时NOx转化率随温度升高而减小 3分
② BC 2分
(3) 肺部CO和O2的浓度分别为10-6mol·L-1和10-2mol·L-1,
 2分
2分
 >2%
2分
>2%
2分
故,抽烟会造成人的智力损伤。 1分
1.(16分)(1)(4分)A E (对1个给2分,错1个0分)
(2)(6分) ① 400(3分,单位刚好消去)
②0.04 mol·L-1·min-1(3分,列出正确的计算式给2分)
(3)(6分)二甲醚 (3分,写CH3OCH3给1分)
(CH3)2O-12e-+3H2O=2CO2+12H+ 或 C2H6 O -12e-+3H2O=2CO2+12H+(3分)
(电极反应:化学式正确给2分,配平1分)
4.(16分) 氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为
;
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H<0,得到如下数据:
2NH3(g) △H<0,得到如下数据:
|
实验组 |
温度/℃ |
起始量/mol |
2分钟/mol |
平衡常数 |
|
|
H2 |
N2 |
NH3 |
|||
|
1 |
298 |
6 |
2 |
1.2 |
4.1×106 |
|
2 |
398 |
3 |
1 |
0.8 |
K1 |
请回答下列问题:
① 反应的平衡常数表达式为 ;
K1的相对大小,K1_______4.1×106(填写“>”“=”或“<”);
②实验1中以υ(H2) 表示的反应速率为 ;
③下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.υ(N2)(正) =3υ(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3) NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
3.(16分)日本核泄漏中最危险的是131I,它能引发甲状腺癌。但127I却是人体必需的。
 (1)下列有关碘的描述中,正确的是 。
(1)下列有关碘的描述中,正确的是 。
A. I、 I、 I、 I是四种相同的核素
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I。碘盐含127I为 30mg·kg-1,成人一次摄入碘盐约3kg才有预防效果。所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I 为100 mg /片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射
(2)碘盐(含KIO3)含碘量可用下列方法来测定:
IO3-+5I -+6H+=3I2+3H2O ; I2+2S2O32-= 2I -+S4O62-
取a g碘盐于锥形瓶中,用适量水溶解,再加入过量的KI溶液并用硫酸酸化,用b mol·L-1 Na2S2O3溶液滴定I2,滴定终点时用去c mL Na2S2O3溶液,则该盐中碘的质量分数为 (用a、b、c表示)。
(3)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+ I -(aq) I3-(aq) ……①
I3-(aq) ……①
I2(aq)+2I
-(aq) I 42-(aq)
……②
I 42-(aq)
……②
则反应②的平衡常数表达式,K= 。
I2的起始浓度均为0.1mol·L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
|
KI起始浓度/mol·L-1 |
0.02 |
0.04 |
0.06 |
0.08 |
0.10 |
|
I3-% |
88.98 |
88.04 |
85.28 |
82.26 |
79.23 |
|
I42-% |
4.38 |
8.67 |
12.60 |
16.21 |
19.53 |
根据表中数据,可得出的两条结论是
、
。
2.(16分)汽车排气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOx转化率,绘得图象如下图所示:

①从图中可以得出的结论是
结论一:从测定NOX转化数据中判断,相同温度下
结论二:
②在上述NO2和C3H6反应中,提高NO2转化率的措施有 。(填编号)
A.加入催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
(3) CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白(Hb·CO),在37℃时:CO+Hb·O2 O2+Hb·CO K=220
O2+Hb·CO K=220
实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也可造成人的智力损伤。抽烟后,测得平衡时人体肺部的空气中CO和O2的浓度分别为10-6mol·L-1和10-2mol·L-1。请问,抽烟会造成人的智力损伤吗?(写出计算过程)
1.16分) 二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源。
(1)合成二甲醚反应一:3H2(g) + 3CO(g)  CH3OCH3(g)
+ CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)
+ CO2(g) ΔH=-247kJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是 。
A.低温高压 B.加催化剂 C.体积不变充入N2 D.增加CO浓度 E.分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g) CH3OCH3(g)
+ H2O(g)。在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g)
+ H2O(g)。在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
|
物 质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/mol·L-1 |
0.01 |
0.2 |
0.2 |
① 该温度的平衡常数(写计算过程)

②10 min内平均反应速率v(CH3OH) = ;
(3)右图为绿色电源“二甲醚燃料电池” 的工作
原理示意图。该反应的还原剂是 (写名称);
若b电极的反应式为:3O2+12e-+12H+==6H2O,则a电
极的反应式为: 。
3.(16分)(1)碱性(2分) SO32-+
H2O 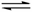 HSO3-+OH- 2分
HSO3-+OH- 2分
(2)②假设1:Na2S 和Na2SO4 ; 2分
假设2:Na2S、 Na2SO3 和Na2SO4。 2分
③
|
实验步骤 |
预期现象和结论 |
|
步骤2:往试管中,加入足量6
mol·L-1 HCl |
若溶液变浑浊,则说明固体中含有Na2S和Na2SO3;若溶液没有变浑浊,而仅有有特殊气味的气体放出,说明固体中含有Na2S |
|
步骤3:取步骤2中的澄清液于试管,然后往试管中加入少量0.1 mol·L-1 BaCl2 |
若有白色沉淀生成,则说明固体中含有Na2SO4。结合步骤2,若溶液没有变浑浊,只有气体放出,则假设1成立;若溶液变浑浊,则假设2成立。 |
2.Ⅰ、B、D(4分,多选1个倒扣2分)
Ⅱ、(1) SO32- + Br2 + 2 OH- = H2O + SO42- + 2Br- (4分)
(2) (8分)
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤① |
取少量待测液加入试管中,加入过量的2 mol·L-1盐酸,再滴加适量l mol·L-1BaCl2溶液。(3分) |
|
|
步骤② |
方法1:取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色。(3分)(若再加入四氯化碳,振荡,静置后观察颜色也可) |
溶液呈橙黄色,证明待测液中含Br-。(2分) (下层液体呈橙红色,证明待测液中含Br-。) |
|
方法2:另取少量待测液加入试管中,加入足量的2 mol·L-1盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色。(3分)(若再加入四氯化碳,振荡,静置后观察颜色也可) |
溶液呈橙黄色,证明待测液中含Br-。(2分) (下层液体呈橙红色,证明待测液中含Br-。) |
|
|
|
|
1.(16分)
(1)D E(或D与E其中1个都给2分。因为一般蒸发皿最多可装70mL,有老师提出可以分次蒸发) (2) ① B(2分) ②同时含有Br2 和 Br- (2分,错一个0分)
③(10分)
|
实验步骤 |
预期现象和结论 |
|
步骤1:足量(过量)苯加入试管中(1分),充分振荡(1分),静置(1分)。 |
若上层有机层仍然为无色(或未出现橙红色),则假设2、3不成立(或:可能假设1成立,1分)。 |
|
步骤2:分液漏斗中静置(1分),分层后放2~3mL下层溶液于另一试管中(1分),用胶头滴管滴加2~3滴0.10mol/LAgNO3于该试管中(1分)、再滴入2~3滴0.10mol/LHNO3(1分) |
若出现浅黄色沉淀,则假设1或3成立(1分);若没有浅黄色沉淀,则假设1、3不成立(1分)。 |
(说明:在含Br2的溶液中加AgNO3溶液,也会有AgBr沉淀,因为Br2+H2O HBr+HBrO)
HBr+HBrO)
方案二:[因为海水中Cl-浓度比Br-浓度大,步骤2加入AgNO3溶液AgCl干扰,可能不容易看到浅黄色。有可能学生在限选试剂外的第(2)问中选H2O2来氧化后再萃取。这种情况有教师建议也给分]
|
实验步骤 |
预期现象和结论 |
|
步骤1:足量(过量)苯加入试管中(1分,或倒入分液漏斗中),充分振荡(1分),静置(1分)。 |
若上层有机层仍然为无色(或未出现橙红色),则假设2、3不成立(或:可能假设1成立,1分)。 |
|
步骤2:分液漏斗中静置(1分),分层后放2~3mL下层溶液于另一试管中(1分),加入适量H2O2(1分)、再滴入一定量的苯(1分) |
若苯层出现橙红色,则假设1或3成立(1分);若苯层没有出现橙红色,则假设1、3不成立(1分)。 |
0.1 mol·L-1AgNO3;CCl4;新制饱和氯水。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤① |
|
有白色沉淀生成,证明待测液中含SO42-。 |
|
步骤② |
|
|
|
步骤③ |
|
|
|
…… |
|
|
3.(16分)化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后固体进行元素定性定量分析,确定固体组成与Na2SO3无异;但把加热后固体溶于水,得到的溶液pH值比Na2SO3溶液的pH高。
(1)Na2SO3溶液呈 性(填“酸”或“碱”),其原理是(以相关的离子方程式表示) 。
(2)强热后的物质是什么呢?同学作如下探究
①分析猜想:Na2SO3在强热下发生了分解反应(自身氧化还原反应)
②该残留物可能的存在物质:
假设1: ;
假设2: 。
③设计实验方案证明你的假设,请按下表格式完成相关内容。(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6 mol·L-1 HCl、0.1 mol·L-1 BaCl2、0.1 mol·L-1KCl、蒸馏水)
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 |
固体全部溶解 |
|
步骤2: |
|
|
步骤3 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com