
题目列表(包括答案和解析)
1.(1)(6分)磷酸(2分,写化学式给1分) C9H11O6P (2分) 4(或“四”,2分)
(2)(5分)10 (或“十”,3分) 2(或“二”,2分)
(3)原答案为:(4分)AD(对1个给2分,错1个0分)附:发生的反应和生成物如下:
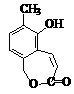
|
所以(3)的评分细则修改为:AD给4分;只选A也给4分;错1个分。
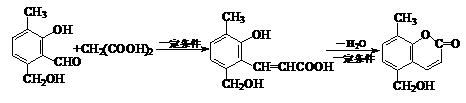
3.(16分)邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一
试回答下列问题:
(1)化合物II→化合物III的有机反应类型
(2)化合物III在银氨溶液中发生反应化学方程式
(3)有机物X为化合物IV的同分异构体,且知有机物X有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出化合物X的结构简式
(4)下列说法正确的是(双选)
A. 化合物I遇氯化铁溶液呈紫色 B. 化合物II能与NaHCO3溶液反应
C. 1mol化合物IV完全燃烧消耗9.5molO2 D. 1mol化合物III能与3 mol H2反应
(5)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为 。
2.(16分)化合物Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ和Ⅳ

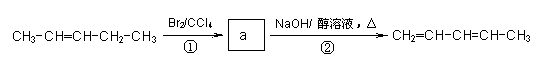 化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
(1)a的结构简式是 ; ②步的反应类型是 。
(2)用甲醇与某有机物发生酯化反应可合成化合物Ⅱ,写出该反应的化学方程式 。
(3)化合物Ⅳ是Ⅲ的同分异构体,也有同样的六元环。Ⅳ的结构简式为 。
(4)化合物Ⅴ(结构见虚线右图)是Ⅲ的同分异构体,下列描述正确的是 (填序号,双选)。
A.Ⅴ可与浓溴水发生取代反应
B.Ⅴ可与Na2CO3溶液反应放出CO2
C.Ⅴ可与二元羧酸发生缩聚反应生成高分子化合物
D.Ⅴ不可能在热的浓硫酸中发生消去反应
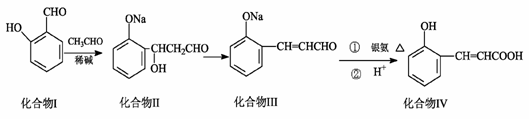
1.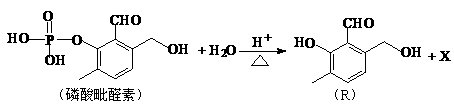 (15分)磷酸毗醛素是细胞的重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯。它在酸性条件下水解反应为:
(15分)磷酸毗醛素是细胞的重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯。它在酸性条件下水解反应为:
(1)则X的名称为 ;磷酸毗醛素的化学式为` ,1mol磷酸毗醛素最多可以与 mol的NaOH反应。
(2)1mol有机物R完全燃烧需要 mol的O2;在光照条件下,R的一氯代产物有 种。
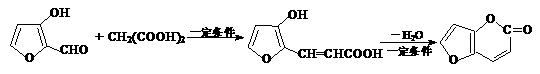 (3)已知反应:
(3)已知反应:
R也能与CH2(COOH)2发生上述反应,下面对R发生该反应的最终产物说法正确的是 。
A.能与溴水发生加成反应 B.1mol该产物在铂催化下可与5molH2加成
C.能发生取代和消去反应 D.可发生水解和酯化反应,有可氧化的醇羟基
2.(16分)
(1)H2SO4溶液
(2)2H++ClO-+2Fe2+ =Cl-+2Fe3++H2O
(3)ZnO (2分) ,除去Fe3+和Al3+,防止Zn2+沉淀析出
(4)Zn+Cd2+=Zn2++Cd
(5)保持一定的酸度(2分) (除标明外,其余每空3分)
3.(16分)(1)H2O2 + 2Fe2+ +2H+ = 2Fe3+ +2H2O (4分)
(2)碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,(2分)使铁离子沉淀完全 (2分)
(3)NaCl、 CoCl2 (HCl不写不扣分) (4分)
(4)减压烘干晶体表面的水分;或常温下晾干;或常温下鼓风吹干,或低于100度小心烘干等,但是不能用高温烘干(4分)
3.(16分)有关钴和铁化合物的性质见下表
|
分子式 |
溶度积Ksp |
沉淀完全时的pH |
氯化钴晶体的性质 |
|
Co(OH)2 |
5.9×10-15 |
9.4 |
CoCl2·6H2O呈红色,常温下稳定。110-120℃时脱水变成蓝色无水氯化钴。 |
|
Fe(OH)2 |
1.6×10-14 |
9.6 |
|
|
Fe (OH)3 |
1.1×10-36 |
3.7 |
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑。工艺流程如下:
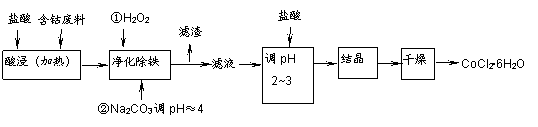
试回答:
 (1)“净化除铁”中,写出加入H2O2时反应的离子方程式 。
(1)“净化除铁”中,写出加入H2O2时反应的离子方程式 。
(2)②步中用Na2CO3调pH≈4的原因是 。
(3)“滤液”中所含主要溶质的化学式是 。
(4)为防止CoCl2·6H2O脱水,“干燥”时可采用的方法或操作是 。
.1.(1)(5分)2ZnS+3O2=====2ZnO+2SO2(3分) 6(2分)
(2)①(4分)写为Zn2+、ZnOH+或Zn(OH)2之中的两个都给分,每个2分
 ②(4分)Zn2++4OH-==Zn(OH)42- 或分步写:Zn2++2OH-==Zn(OH)2↓(2分)、Zn(OH)2+2OH- == Zn(OH)42-(2分)
②(4分)Zn2++4OH-==Zn(OH)42- 或分步写:Zn2++2OH-==Zn(OH)2↓(2分)、Zn(OH)2+2OH- == Zn(OH)42-(2分)
③(4分)由于在Zn(OH)2浊液存在溶解平衡:Zn(OH)2(s) Zn2+(aq)+2OH-(aq) (1分),而Ksp[Zn(OH)2]> Ksp(ZnS) (1分),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,(1分)溶解平衡继续向右移动直至全部转化为ZnS(1分)。[合理叙述参照给分]
Zn2+(aq)+2OH-(aq) (1分),而Ksp[Zn(OH)2]> Ksp(ZnS) (1分),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,(1分)溶解平衡继续向右移动直至全部转化为ZnS(1分)。[合理叙述参照给分]
2.16分)炼锌厂产生的工业废渣--锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
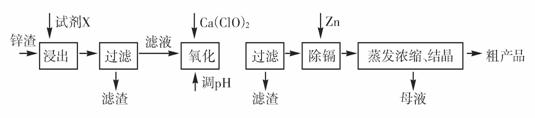
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7
试回答下列问题:
(1)浸出时用到的试剂X为
(2)写出加入Ca(ClO)2反应的离子方程式
(3)调节pH过程可以选用 (填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是
(4)写出过滤后加入过量的锌粉反应的离子方程式
(5)在蒸发浓缩操作时,要采取实验措施
1.17分)请回答有关锌及其化合物的问题。
(1)高温锻烧时,闪锌矿(ZnS)与氧气反应生成ZnO和SO2。其反应方程式为:
,该反应1mol还原剂失去电子 mol。
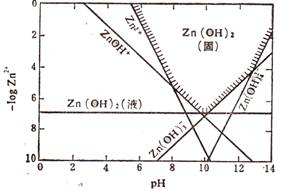 (2)已知Zn(OH)2具有两性,在过量的强碱性溶液中生成可溶于水的Zn(OH)42-。右图是Zn2+在某温度时水解、沉淀、溶解的曲线图。
(2)已知Zn(OH)2具有两性,在过量的强碱性溶液中生成可溶于水的Zn(OH)42-。右图是Zn2+在某温度时水解、沉淀、溶解的曲线图。
①当pH=7、c(Zn2+)=0.01mol·L-1,Zn2+主要存在形式为 、 (写化学式)。
②向c(Zn2+)=1×10-5mol·L-1的溶液中加入固体NaOH到pH=13,其反应的离子方程式为 。
③已知该温度下的Ksp[Zn(OH)2]=1×10-17、Ksp(ZnS)=1.6×10-24。当向新生成的Zn(OH)2浊液中滴入足量的Na2S溶液,振荡后Zn(OH)2会全部转化为ZnS,其原理是:
。
4.(1) 46.1KJ (3分)
(2)
① 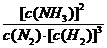 (3分);
< (2分);
② 0.45mol/(L·min) (3分); ③ C(2分)
(3分);
< (2分);
② 0.45mol/(L·min) (3分); ③ C(2分)
(3)
NH4+ + D2O NH3·HDO + D+(3分)
NH3·HDO + D+(3分)
3.(16分)(1)BCD (4分)(答对1项得1分,全正确4分。错选倒扣1分,最少0分)
(2) 2.1×10-2bc/a (或127bc×10-3bc/6a,其它正确表示也给分) (4分)
(3) 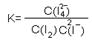 (4分)
(4分)
结论:(4)条件相同时,I3-离子的物质的量分数组成始终占绝对优势(或I3-含量高,I42-含量低)(2分);‚随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加(2分,若把物质的量分数组成的变化答为浓度的变化不给分);或进一步提高I-离子的浓度可增加I42-的物质的量分数或降低I3-离子的物质的量分数等;③随I-离子浓度的增加,反应‚平衡正向移动的幅度大于反应 (2分)。(共4分,每条2分,该小题总分不超过4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com