
题目列表(包括答案和解析)
7、一、①.先打开活塞K,吸入部分空气关闭活塞K,记下刻度,然后推或拉注射器活塞,松手后看注射器活塞是否复原。(方法一)或先打开活塞K,吸入部分空气,关闭活塞K。然后用手握住注射器有空气的部分,看活这否上移,松手片刻后,再看活塞是否复原。
③.浓HNO3与Cu片剧烈反应并逐渐溶解,产生大量红棕色气体,溶液度为绿色(蓝色),注射器活塞不断上移。
6、⑴ a - e,d - f,g - h,i - b,c - f (3分)
⑵ 除去CO中的水蒸气 (2分)
防止空气中的水蒸气进入丁,被碱石灰吸收,影响测定结果 (2分)
⑶ 点燃(或用气囊把CO收集起来) (2分)
⑷ A (3分)偏高 (2分)
重复上述实验多次,取x和y比值接近的几次,取平均值。
(或继续通入CO还原FexOy,再称量干燥管的增重质量,直至最后两次称量误差不超过0.1 g)(注:只要答出平行实验或恒重实验就酌情给分) (3分)
⑸ m(FexOy)和m(Fe) (1分) m(Fe)和m(CO2) (1分)
5. 氯化钡溶液 氢氧化钠溶液 氨水
(1) 洗涤沉淀 向过滤器中注入蒸馏水至浸没沉淀,让水流尽.重复数次 蒸发溶液 边加热边搅拌,至出现较多的晶体时停止加热.
(2) 使Fe2+氧化为Fe3+ 取少量溶液B,向其中滴加酸性高锰酸钾溶液,看是否褪色,若不褪色,则说明已适量
(3) 生成的沉淀刚好溶解
(4) AlCl3 BaCl2 NaCl 否 在E中加入氨水后过滤,杂质自然分离
未在酸性氛围中蒸发 AlCl3、 FeCl3会部分水解而得不到纯净的AlCl3 、FeCl3固体
4. (1)第①、④两步不严密;第①步中“任取两份氯酸钾”应改为“准确称量两份等质量的氯酸钾”,第④步中应改为“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量”。
(2)a接g、f接d、e接b。
提示:(1)要证明氧化铜是催化剂,须证明反应前后氧化铜的质量没有变化、氧化铜的化学性质没有改变,所以这是一个定量实验,不能任取两份氯酸钾。
(1) 分析题给实验装置图,可知是用H2还原氧化铜的方法来证明分离出来的固体仍是氧化铜,进而证明氧化铜是催化剂。a中产生H2通入g,目的是用浓硫酸来干燥H2;再经f接d、e(或d),目的是使H2跟氧化铜反应生成铜和水;进而接b(或e),使产生水蒸气跟无水硫酸铜反应生成蓝色硫酸铜晶体,证明有硬质玻璃管中发生反应;未端再接g是为了防止空气中水蒸气进入U管。
3、(1)SO2(g)+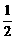 O2(g)= SO3(g),ΔH=-98.3kJ/mol
(2)提高二氧化硫的转化率;浓H2SO4
O2(g)= SO3(g),ΔH=-98.3kJ/mol
(2)提高二氧化硫的转化率;浓H2SO4
(3)给催化剂加热;
(4)防止温度过高,降低SO2转化率及催化剂活性(答出一点得1分)
(5)降温,使SO3凝结成晶体;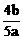 或
或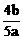 ×100%
×100%
(6)将尾气通入盛有浓硫酸的洗气瓶后再通入盛有氢氧化钠溶液的洗气瓶(或通入盛有足量碱石灰的干燥管等)
(只答通入氢氧化钠溶液不得分。只要保证SO2和SO3不污染环境,SO3不与空气中的水接触的合理方案均给分)
2. ⑴ A. 饱和石灰水或NaOH溶液 B.试样 C.稀H2SO4(若答盐酸,不给分) D.浓H2SO4 E. 碱石灰(过量) (每空1分)
⑵ ③在接球形干燥管前,先检查装置的气密性 ⑤打开甲、乙弹簧夹,用气球鼓气,以赶尽装置中的CO2,然后接上已称量过装有吸收剂的球形干燥管 ⑥将分液漏斗中的稀H2SO4加到装有试样的平底烧瓶上 ⑦反应完全后,打开弹簧夹甲,用气球鼓气,直至装置中的CO2全部赶出为止 (每空2分)
1.⑴根据NaOH和Na2CO3的性质知识可知,甲同学所得ng固体为BaCO3,由碳酸根守恒可得,混合物中碳酸钠的质量分数为: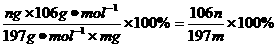 ;精确度高的原因通常有二个,一是实验因素,如①CO32-应完全转化为沉淀;②所得沉淀必须纯净。由于Ca(OH)2微溶于水,所以在NaOH、Na2CO3混合溶液中加入Ca2+时,所得的CaCO3沉淀中可能混有Ca(OH)2。二是计算的因素,如分子相同时,分母越大,计算误差越小。由于碳酸钡的相对分子质量比碳酸钙大,在CO32-量一定的条件下,加入BaCl2生成的沉淀质量大,计算Na2CO3质量分数的误差就较小。
;精确度高的原因通常有二个,一是实验因素,如①CO32-应完全转化为沉淀;②所得沉淀必须纯净。由于Ca(OH)2微溶于水,所以在NaOH、Na2CO3混合溶液中加入Ca2+时,所得的CaCO3沉淀中可能混有Ca(OH)2。二是计算的因素,如分子相同时,分母越大,计算误差越小。由于碳酸钡的相对分子质量比碳酸钙大,在CO32-量一定的条件下,加入BaCl2生成的沉淀质量大,计算Na2CO3质量分数的误差就较小。
⑵在中和滴定中,涉及到的玻璃仪器有:酸式滴定管和锥形瓶,加入过量BaCl2溶液的目的是使碳酸钠全部转化为BaCO3沉淀,防止CO32-与盐酸反应。
⑶将反应产生的CO2排出,完全被碱石灰吸收,装置A的作用是吸收空气中的CO2,防止其干扰。
14.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色的溶液中通入SO2气体,又产成白色沉淀;将白色沉淀加入稀硫酸中,又生成红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有 A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,溶于H2SO4发生自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
综合实验答案
13、新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 ___________________________ _______________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色? |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①_____________ ______________。 ②_______________ ______________。 ③______________ _______________。 ④ H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:______________ ________________ 实验③:把红色布条放在水里,布条不褪色。 |
________ _________ |
已知次氯酸酸性介于碳酸和碳酸氢根之间,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
②氯气和碳酸钠按照1︰1的比例恰好反应_____________________________________;
③将过量的氯气通入到少量的碳酸钠溶液______________________________________。
12、[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备[(NH4)2SO4·FeSO4·6H2O]。 实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得[(NH4)2SO4·FeSO4·6H2O]。
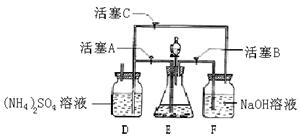
试回答下列问题:
(1)用Fe屑和稀H2SO4反应产生的氢气赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,其目的是 ;操作时应先关闭活塞 ,并同时打开活塞 ;
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用 。
(2)使[(NH4)2SO4·FeSO4·6H2O]结晶的实验操作是:将硫酸亚铁溶液与硫酸铵溶液的混合液转移至蒸发皿中, ,
得到[(NH4)2SO4·FeSO4·6H2O]晶体。
(3)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com