
题目列表(包括答案和解析)
8、(由成都七中2009-2010学年度高三年级考试理科综合第28题改编)
(本题共16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
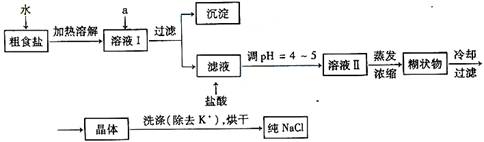
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为__________________(填化学式);滤液中滴加盐酸调PH=4-5的目的是 __ ;
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量KCl,检验NaCl是否洗净的方法是 ;
 (2)用提纯的NaCl配制480mL 4.00 mol·L-1NaCl溶液,需要称取的质量为 g,所用仪器除药匙、玻璃棒、烧杯外还有_____________(填仪器名称);
(2)用提纯的NaCl配制480mL 4.00 mol·L-1NaCl溶液,需要称取的质量为 g,所用仪器除药匙、玻璃棒、烧杯外还有_____________(填仪器名称);
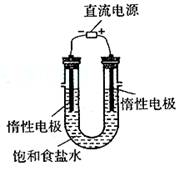
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 _____(填“>”、“=”或“<”)2L,原因是_____________________________________。
命题意图:化学实验题在高考理综卷中是必考题,每年实验题的出现形式都有不同的特点。本题除了涉及粗盐提纯这一实验的基本操作,还覆盖了物质的量浓度的配制,电化学等知识体系,这样多维度知识点出现在同一试题中,比较接近近几年的高考命题规律。
7、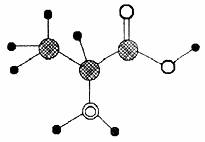 (北京市西城区高三年级抽样测试9改编)
(北京市西城区高三年级抽样测试9改编)
右图是某有机物分子的简易球棍模型,该有
机物中中含C、H、O、N四种元素。下列
关于该有机物的说法中错误的是 ( )
A.分子式为C3H7O2N
B.能发生取代反应
C.能通过聚合反应生成高分子化合物
D.该有机物能跟NaOH溶液反应,但不能和盐酸反应
命题意图:本题不仅考察了球棍模型,有机化学的重要内容--“反应类型”,而且涉及了氨基酸这一有机化学中非主流知识点。许多学生对于氨基酸的两性问题知之甚少,本题的出现在旨在提醒学生对重点内容的把握和非主流知识体系的兼顾。
第Ⅱ卷(非选择题 共58分)
6、(天津市20中学2009届高三第二次模拟第6题改编)
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H>0。现将1molA和2molB加入 甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H>0。现将1molA和2molB加入 甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
命题意图:化学平衡是高中化学基本理论部分较为抽象的知识体系,而等效平衡则是这一知识体系中的难点所在,不少学生一遇到等效平衡的试题就不知所措,尤其是结合实验模型和函数图像就更是雪上加霜。本题的出现旨在引导学生正确面对这一现状,系统的分析等效平衡的规律,争取做到胸有成竹。
5、(原创题)下列离子方程式正确的是
A.等物质的量浓度的FeI2溶液与溴水等体积混合2Fe2++2I-+2Br2=2Fe3++I2+4Br-
B.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ ==Fe3+ + 3H2O
C.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
命题意图:离子方程式历来是化学教学中的重点,也是高考较为容易考察到的知识点。离子方程式的涉及面很广,尤其是和氧化还原反应或因为反应物量不同导致的多可能反应结合起来,学生显得最为困难。本题的出现旨在引起学生对于离子方程式的重视。
4、(原创题)设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,18克H2O所含电子数为10 NA
B.将1mol FeCl3全部化成胶体,其中氢氧化铁胶粒数为NA
C.在常温常压下,11.2L氧气所含的原子数目为NA
D.标准状况下2.24L的SO3所含的原子数为0.4NA
命题意图:阿伏加德罗常数所涉及的知识点有相当丰富,导致阿伏加德罗常数相关试题在高考中的出现频率极高,近几年理科综合浙江卷中,只有08,10年未出现这一知识点,其余众多年份都有考到,足以说明阿伏加德罗常的重要性。
3、(2010届华维中学高三专题复习第1题)下列结论均出自《实验化学》中的实验,其中错误的是
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘。
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据。
C.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干。
D.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量。
命题意图:本题各个选项都来源于《实验化学》一书,新教材把实验化学单独列为一册,与老教材相比,不仅涉及实验的基本操作,定性、定量实验,制备合成实验等,还结合了许多全新实验案例,而这些案例中有许多固定的细节问题。我们在教学中往往容易凭借老教材的教学经验,忽略了这些案例中的细节,本题的出现旨在唤起师生对《实验化学》一书的重视。
2.(原创题)我们学习化学很重要的一个方面就是解决生活中的实际问题,下列家庭小实验不合理的是
A.用灼烧并闻气味的方法检验真皮衣料
B.用淀粉和水检验食盐中的碘元素
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用食醋除去热水壶中的水垢
命题意图:近几年高考命题都有一个共性,就是与生活实际联系非常紧密。我们的学生却刚好相反,对于一些生活中常见的问题,当需要用化学知识去加以解释时,常常显得束手无策,本题旨在引起学生重视生活相关的化学问题。
1、(原创题)下列说法中不正确的是 ( )
① 铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
② 汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
③ 用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖;
④ 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
⑤ 明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝;
⑥“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
A. ②③⑤ B. ①②④ C.③④⑥ D. ③④⑤
命题意图:高中化学所涉及的知识点有很多,分布在不同的模块中,但理科综合化学部分只有“7+4”,题量之少,但又要尽可能多的覆盖到各类知识模块,本题的出现就能很好解决这一矛盾。
3.(16分)
(1)消去反应 3分
(2)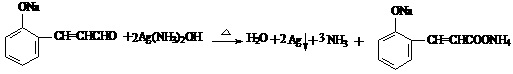
3分
(3)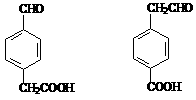 4分(每个2分,共4分)
4分(每个2分,共4分)
(4)AC 3分
(5)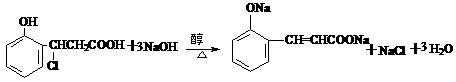 或
或
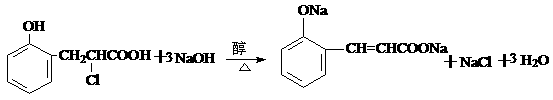
3分
2.(16分)(1) a: (2分);②:消去反应(2分)
|
 (2)OHC-CH=CH-COOH+HOCH3
OHC-CH=CH-COOCH3 +H2O(4分)
(2)OHC-CH=CH-COOH+HOCH3
OHC-CH=CH-COOCH3 +H2O(4分)
(3)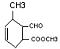 (4分)
(4)AC(4分,多选1个倒扣2分)
(4分)
(4)AC(4分,多选1个倒扣2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com