
题目列表(包括答案和解析)
8.( 2011年三月浙江金华、丽水、衢州十二校联考 改编)(16分)I、物质A-G有下图所示转化关系(部分反应物、生成物没有列出)其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。

请回答下列问题
(1)写出下列物质的化学式:B ▲ E ▲ G ▲
(2)工业上B制备D在 ▲ 设备中进行.
(3)反应②的化学方程式是 ▲ 。
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K= ▲ L·mol-1,若温度不变,再加入0.50 mol氧气后重新达到平衡,平衡 ▲ (填“向左”、“不变”、“向右”)移动,氧气的转化率 ▲ ,(填“升高”“不变”或“降低”),D的体积分数
▲ (填“增大”“不变”或“减小”)
II、“蓝瓶子”实验中使用的亚甲基蓝(C16H18ClN3S·3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne- 还原型(无色)
还原型(无色)
将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色……
⑴上述溶液由蓝色变无色的过程中,亚甲基蓝被 ▲ (填“氧化”或“还原”,下同),其中 ▲ 剂是 ▲ (填物质名称)。
⑵上述溶液由无色变蓝色的过程中,亚甲基蓝被 ▲ (填“氧化”或“还原”,下同),其中氧化剂是 ▲ (填物质名称)。
7.迷迭香酸是从蜂花属植物中提取到的酸性物质,其结构
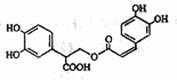 如下图所示。下列叙述正确的是 ( )
如下图所示。下列叙述正确的是 ( )
A.迷迭香酸的分子式为C18H15O8
B.该物质能使溴水或高锰酸钾溶液褪色,但不能与FeCl3溶液 发生显色反应
C.1mol迷迭香酸跟H2反应,最多消耗6molH2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
6.(原创)下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
在滴有酚酞的Na2CO3溶液中, 加入CaC12溶液后红色褪去 |
验证Na2CO3溶液中存在水解平衡 |
|
B |
将SO2通入中KMnO4溶液中 |
验证SO2具有漂白性 |
|
C |
淀粉溶液和稀H2SO4混合加热,后加新制的Cu(OH)2悬浊液加热至沸腾 |
检验淀粉水解产物有还原性 |
|
D |
将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 |
检验气体中含有乙烯 |
5.(江门市2011届高三期末调研改编)
用0.1 mol·L-1的氢氧化钠滴定0.10 mol·L-1的醋酸,滴定过程中不可能出现的结果是
A.c(Na+)>c(CH3COO-),c(OH-)>c(H+)
B.c(CH3COO-)>c(Na+),c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-),c(OH-)=c(H+)
D.c(CH3COO-)>c(Na+),c(H+)> c(OH-)
4.(原创)下列离子方程式正确的是
A.在稀氨水中通入少量CO2:NH3·H2O+CO2===NH+HCO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
C、过量的NaHSO4与Ba(OH)2溶液反应:Ba2+十OH-十H+十SO42-=BaSO4↓ 十2H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
3.( 09年海南卷16题改编)下图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是
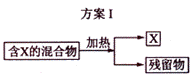
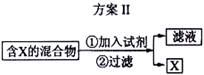
A.可以选用方案Ⅰ分离NaCl中的NH4Cl
B.方案Ⅰ中X物质不可能是受热易分解的物质
C.方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3
D.方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂
2.(原创)以NA 表示阿伏加德罗常数,下列说法正确的是
A.1mol-CH3和1molOH-都含有10NA个电子
B.1mol 过氧化氢分解转移4 mol电子。
C.标准状况下,22.4LO2和HCl混合气体所含原子数为2NA
D.1mol Cl2与足量氢氧化钠反应,转移的电子数为2NA
1、(原创)生活中的一些问题常涉及到化学知识,下列叙述不正确的是
A.维生素C具有还原性,在人体内起抗氧化作用
B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子
C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情。
D. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁。
11、(2009无锡调研28改编)(14分)苯佐卡因是一种局部麻醉剂,可用于粘膜溃疡、创面等的镇痛,一般制成软膏或栓剂使用,它的工业合成有如下所示的两种途径。途径I已逐渐淘汰,现在使用较多的是途径II。
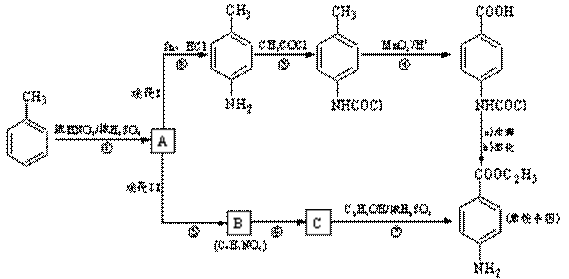 已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
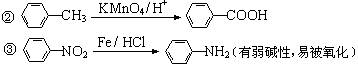 请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成
请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成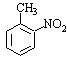 、
、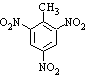 等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2O
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。
等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2O
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。
9.(原创)(14分)25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
 (2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
醋酸的电离程度将如何变化
电离平衡常数将如何变化 (4)合成氨发生的反应为N2+3H2 2NH3。400"C时,该反应平衡常数K=0.5mol-2。·L2。已知该反应的平衡常数与温度的关系如图所示。500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正 v(N2)逆
(填>、<、=或不能确定)。请书写判断理由
10.(2010徐州一研18)(16分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
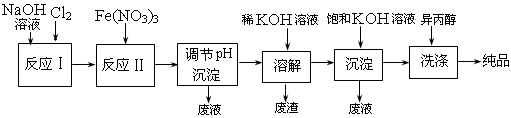
(2) ①反应I的化学方程式为
。
②反应II的离子方程式为
。
③加入饱和KOH溶液的目的是
。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为
,__________。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
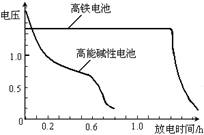
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com