
题目列表(包括答案和解析)
2.(原创)下列离子方程式不正确的是
A.苯酚溶液中加入Na2CO3:C6H5OH+CO32―→C6H5O―+HCO3―
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2++OH―+H++SO42―=BaSO4↓+H2O
C.向Ba(OH)2溶液中加入过量NaHSO3溶液: 2HSO3―+Ba2++2OH―=BaSO3↓+SO32―+2H2O
 D.甲醇-氧气燃料电池(KOH溶液作电解质溶液)负极的电极反应式:
CH3OH―6e―+8OH―=CO32―+6H2O
D.甲醇-氧气燃料电池(KOH溶液作电解质溶液)负极的电极反应式:
CH3OH―6e―+8OH―=CO32―+6H2O
1.(原创)下列有关海水综合利用的说法正确的是( )
A.从海水中可以得到NaCl,NaCl是制造化肥的原料
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质
D.利用潮汐发电是将化学能转化为电能
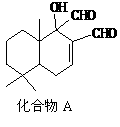
11.(14分)有机物A是一种军用催泪弹的主要有效成分。经分析A的相对分子质量为161,除含有C、H元素外,它还含有一种卤族元素,且分子中只含有一个甲基。化合物A-F的转化关系如下图所示,其中足量的新制Cu(OH)2悬浊液与1 mol C反应可生成1 mol Cu2O 和1 mol D,B1和B2均为较稳定的化合物且互为同分异构体。




②一个碳原子上连有两个碳碳双键的结构(-C==C==C-)不稳定。
请完成下列问题;
(1)化合物A含有的官能团是__________________________________________。
B1的相对分子质量是__________。
(2)①、②、③的反应类型分别是_____________________________________。
(3)写出A、F的结构简式:
A.__________________;F._______________________________。
(4)写出C―→D反应的化学方程式:________________________________________。
(5)符合下列条件的E的同分异构体共有________种。①含有三个甲基;②能发生酯化反应;③-OH、-Br连在同一个碳原子上。
[解析]此题为原创题。考察有机化学模块中同分异构、基团性质知识点的综合应用
10.(16分)二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象。为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:

①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 注入稀硫酸。打开活塞,将产生的氢气导入到后续装置。
② 后关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的__________滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题
(1)实验步骤①和③的空白处使用的仪器分别为____________、_____________ ;
(2)装置C中苯的作用是____________________;
(3)实验步骤②的操作为_______________________________________________;
(4)实验步骤④的目的是______________________________________________;
(5)写出实验步骤⑤试管中发生反应的化学方程式_________________________;
(6)为了避免产生沉淀,你认为还应采取哪些措施,请举一例_______________。
[解析]此题为原创题。实验装置的变化应用
9.(14分)元素周期表、平衡移动原理是化学反应原理中的重要内容。请回答下列问题:现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)① A-F六种元素原子,原子半径最大的是 (填序号)。
②A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: 。
③B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: 。
④A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: 。
(2)在一定温度下,向一个体积为1.0L的密闭容器中,通入3mol SO2 和2mol O2 及固体催化剂,使之反应:2SO2(g)+O2(g) 2SO3(g);△H=-196.6KJ·mol-1。平衡时容器内气体压强为起使时的90%。
2SO3(g);△H=-196.6KJ·mol-1。平衡时容器内气体压强为起使时的90%。
①加入3mol SO2 和2mol O2 发生反应,达到平衡时放出的热量为 ____________
②该温度下反应的平衡常数是_______________
[解析]此题为原创题。考察周期表的熟悉程度及化学平衡中反应物质和平衡常数的计算
8.(14分)已知:
① 浓磷酸具有吸水性,在加热条件下也难与碳、铜等单质反应。

② 生成环己烯的反应:
③ 相应物质参数表:
|
有机物 |
密度/ g·cm―3 |
熔点/ ℃ |
沸点/ ℃ |
溶解性 |
|
环己醇 |
0.96 |
25 |
161 |
能溶于水 |
|
环己烯 |
0.81 |
―103 |
83 |
难溶于水 |
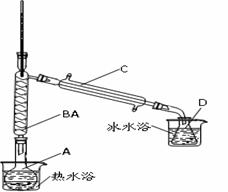
某化学小组用上图所示装置以环己醇为原料制备环己烯,其步骤如下:
步骤Ⅰ. 制备粗品
(1)将12.5mL环己醇加入上图反应装置中的圆底烧瓶A内,再加入2mL质量分数为85%的浓磷酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在锥形瓶D内得到环己烯粗品。其中仪器B的作用是 ;此反应中不加浓硫酸的原因是 。
(2)反应装置的水浴温度控制在85℃左右,而不是130℃,是因为 的缘故。
步骤Ⅱ. 制备精品
(3)为了提纯环己烯,除去粗品中的环己醇、少量酸和水等杂质,采用如下操作:
①加入饱和食盐水,再振荡、静置、分层、分液,其中食盐可起 作用。
②分液后再用 (填序号)试剂洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
③再向粗品中加入无水氯化钙后蒸馏。加入无水氯化钙目的是: 。
(4)以下区分环己烯精品和粗品的方法,合理的是: (填序号)。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
[解析]此题为原创题。考察物质的分离和提纯,蒸馏装置的使用。
7.当温度不变的情况下,有反应:2A(g)+2B(g)
 C(g)+3D(g),ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前体积为2 V(如图1)。关于两容器中反应的说法正确的是
( )
C(g)+3D(g),ΔH<0。现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前体积为2 V(如图1)。关于两容器中反应的说法正确的是
( )

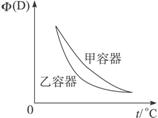
图1 图2
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组分的体积百分组成相同,混合气体的平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲容器中物质C的浓度是乙容器中物质C的浓度的3倍
[解析]此题为原创题。考察化学反应平衡的掌握度
非选择题部分
6.2010年4月,湖北又报道某水域爆发蓝藻。保护环境,保护水资源刻不容缓。蓝藻的形成是由于含N、P等元素的废水排入水域,引发蓝藻的疯狂生长。通过定量实验,分析得知某蓝藻的组成为(质量分数):C-35.80%,O-49.50%,P-0.87%,H-7.37%,N-6.31%。则该蓝藻的化学式为 ( )
A.C106H263O110N16P B.C106H263O111N15P
C.C106H262O111N17P D.C105H262O110N14P
5.蝇类昆虫的雌性信息素可用芥酸(来自白芥)与羧酸X在浓NaOH溶液中进行阳极氧化得到。电解总反应式为
则下列说法正确的是 ( )
A.X为C2H5COOH
B.电解的阳极反应式为: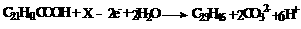
C.电解过程中,每转移2 mol电子,则生成2 mol 雌性信息素
D.阴极的还原产物为H2和OH-
[解析]此题为原创题。电解池电极反应判断,电极反应中关于物质的量的计算
4.醋酸和盐酸是高中化学中常见的两种酸,下列说法正确的是( )
A.物质的量浓度相同的盐酸和醋酸溶液中的H+浓度也相同
B.相同浓度的醋酸和醋酸钠溶液混合,得到溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
C.pH=2的两溶液稀释100倍后,pH都为4
D.两溶液中都加入钾盐,H+浓度都减小
[解析]此题为原创题。主要考察物质水解离子浓度的比较
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com