
题目列表(包括答案和解析)
7、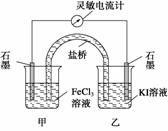 (2009·福建理综,11改编) 将反应2Fe3++2I-
(2009·福建理综,11改编) 将反应2Fe3++2I-
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
A.反应开始时,乙中石墨电极上发生氧化反应
B.电流计读数为零时,达到化学平衡状态
C.乙池中若换为Fe电极和FeCl2溶液,则电流计指针向相反方向偏转
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极仍为正极
6、 (原创)对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图,下列说法不正确的是
(原创)对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图,下列说法不正确的是
A.对羟基肉桂酸的化学式为:C9H8O3
B.对羟基肉桂酸可以发生氧化、取代、酯化、加聚、缩聚反应
C.对羟基肉桂酸既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.对羟基肉桂酸分子中最少有4个碳原子共线,最多所有原子都可能共面
5、 (原创)下列溶液说法正确的是
(原创)下列溶液说法正确的是
A、常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO-3)+3c(CO2-3)+3c(H2CO3)
B、(2010天津卷)图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C、(2010 全国卷)1.0*10-3mol/L盐酸的pH=3.0,1.0*10-8mol/L盐酸的pH=8.0
D、分别将等体积的等pH的醋酸和盐酸加水稀释100倍,所得溶液的pH:③>④
4、(原创)下列实验操作能够实现的是
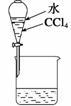
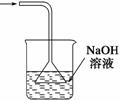
A、浓硫酸的稀释 B、除去氯气中的杂质 C、分离水和四氯化碳D、吸收氯化氢尾气
3、(2011年三月浙江金华、丽水、衢州十二校联考 改编)下列离子方程式的评价正确的是
|
化学用语 |
评价 |
|
A.在碳酸氢镁溶液中加入过量氢氢化钠溶液:Mg2++2HCO3-+2OH-=Mg CO3↓+CO32-+2H2O |
错误:生成物应是Mg(OH)2和Na2CO3 |
|
B.在亚硫酸氢钠中加入少量的次氯酸钠溶液 SO32-+ClO-+H2O= Cl-+2H++SO42- |
正确 |
|
C. 亚磷酸是一种二元酸,在其中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2O |
正确 |
|
D.在过氧化钠中加入稀硫酸: N a2O 2+2H+=2Na++H2O+O2↑ |
正确 |
2、(原创)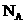 表示阿伏伽德罗常数,下列判断正确的是
表示阿伏伽德罗常数,下列判断正确的是
A、(2010莆田模拟)常温下,1L0.1mol/L的 溶液中铵根离子为0.1
溶液中铵根离子为0.1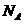
B、(2009 江苏卷)室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
C、(2009·广东改编)22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA
D、(2010·福建)含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
1、(原创)化学与生产、生活、社会密切相关,下列有关说法不正确的是:
A、乙醇汽油是混合型能源,乙醇可由富含淀粉的谷物发酵产生
B、世博停车场安装催化光解设施,可将汽车尾气中的CO和NOx反应生成无毒物质
C、实行“汽车下乡”政策、大力推广使用家用小轿车有利于节能减排
D、废电池要集中处理,防止其中的重金属盐对土壤和水源造成污染
11. (16分)(根据常州市2010-2011学年第一学期期末调研高三化学试题改编)
某芳香烃A(相对分子质量为92)是一种重要的有机化工原料,以它为初始原料经过如下转化关系图(部分产物、合成路线、反应条件略去)可以合成阿司匹林、扁桃酸等物质。其中D能与银氨溶液发生银镜反应。
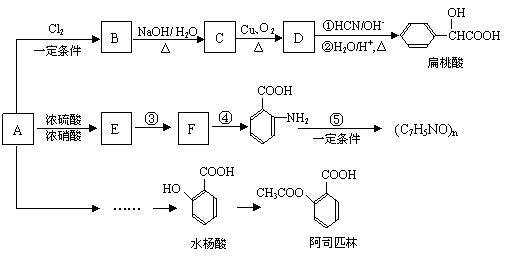
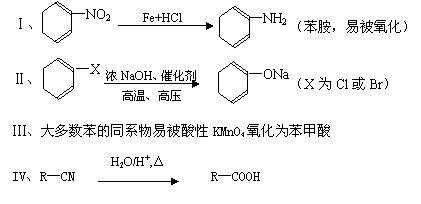 已知:
已知:
⑴B的结构简式为: 。
D转化成扁桃酸的第一步的反应类型为: 。
⑵符合下列条件的扁桃酸的同分异构体共有 种。
①属于甲酸酯 ②含有酚羟基
⑶反应③和④顺序能否对换? ;(填“能”或“不能”)
理由是: 。
⑷写出扁桃酸发生缩聚的化学方程式: 。
⑸写出反应D与银氨溶液的化学方程式: 。
⑹试写出由A合成水杨酸的合理流程图:
①合成过程中无机试剂任选
②合成反应流程图表示方法示例如下:
10.(14分)(原创)在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH == K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04 == K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203== Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用 滴定管移取步骤③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是: ;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是 ;
(3)步骤④的A溶液最合适的是 ;滴定终点的判断方法是 ;
(4)步骤④应该选用 (填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
|
序号 |
滴定前/mL |
滴定后/mL |
|
① |
1.35 |
19.40 |
|
② |
1.05 |
19.00 |
|
③ |
1.58 |
20.91 |
根据数据计算该样品中总二氧化硫的浓度为 mol/L,故该干白葡萄酒是 (填“合格”“不合格”)产品。
9. (14分)(根据肇庆市2011届高三级第一次模拟试题改编)
请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
①已知:2C(s)+O2(g)=2CO(g);ΔH1 , 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)  CO(g)+H2(g);ΔH=
。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=
。(用含ΔH1、ΔH2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
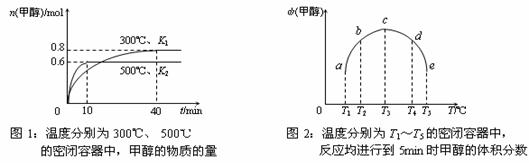
a. 该反应的ΔH3 0(选填“<”、“>”或“=”,下同),K1 K2。
b. 将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有 。
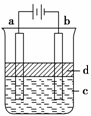 (2)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
(2)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
(a)a电极反应式为 。
(b)电解液c可以是 (填编号)。
A、纯水 B、NaCl溶液 C、H2SO4溶液 D、CuCl2溶液
 (3)右图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况。据图分析:
(3)右图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况。据图分析:
该温度下,溶度积常数的关系为:Ksp[ Fe(OH)3]____Ksp[Mg(OH)2]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com