
题目列表(包括答案和解析)
13. 下列各项不正确的是
A. 碳酸氢钙溶液中加入过量的氢氧化钠溶液的离子方程式:
Ca2++2HCO3-+2OH- = CaCO3↓+2H2O+CO32-
B.使pH试纸显红色的溶液中,Fe2+、K+、NO3-、Cl-不可能大量共存
C.铁在较强酸性环境中发生电化腐蚀的正极反应方程式是:2H2O+O2+4e-=4OH-
D. 标况下,将盛满HCl气体的烧瓶倒立在盛有足量水的水槽中,足够时间后烧瓶中所得溶液的物质的量浓度为1/22.4 mol/L
第II卷(非选择题,共174分)
12.常温时,下列关于电解质溶液的叙述正确的是
A.稀释pH= 3的醋酸溶液,溶液中所有离子的浓度均降低
B.pH=4的盐酸和PH=10的氨水等体积混合,所得溶液中离子浓度大小顺序是:
C(Cl-)>C(NH4+)> C(H+)> C(OH-)
C.等物质的量浓度的碳酸钠溶液与碳酸氢钠溶液相比,碳酸钠溶液的pH大
D.分别中和pH与体积均相同的硝酸和醋酸溶液,硝酸消耗氢氧化钠的物质的量多
11.对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得。
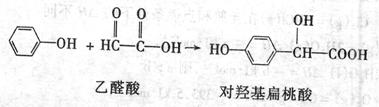
下列有关说法不正确的是
A.上述反应的原子利用率可达到100%
B.对羟基扁桃酸苯环上的一硝基取代物有两种
C.lmol对羟基扁桃酸与足量NaOH溶液反应,消耗2 mol NaOH
D.对羟基扁桃酸可以发生加成反应、取代反应和加聚反应
10. “类推”是常用的学习方法,但是有时会产生错误结论。下列类推结论中
正确的是
A、钠在空气中可生成氧化钠、过氧化钠,则锂可生成氧化锂、过氧化锂
B、第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢
化物稳定性的顺序也是HCl>H2S>PH3
C、卤素单质的沸点从上到下依次升高,则碱金属单质的沸点从上到下也依次升高
D、浓硫酸敞口放在空气中质量增大,浓度变小,则浓硝酸敞口放在空气中也质量增大,浓度变小。
9.某无色溶液中只可能含有Na+ 、Ba2 +、 Cl一、 Br一、SO32一、SO42一,对该溶液进行下列实验,实验操作和现象如下表:
|
步骤 |
操 作 |
现 象 |
|
(1) |
取少量溶液滴加几滴石蕊试液 |
溶液变蓝 |
|
(2) |
另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 |
上层无色,下层呈橙红色 |
|
(3) |
取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 |
有白色沉淀产生 |
|
(4) |
向(3)的滤液中加入过量AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定有含 Na+、 Br一、SO32一 B.肯定没有 Ba2 +、Cl一、Br一
C.不能确定 Na+ 、 SO32一、SO42一 D.可能含有 Cl一、 SO32一、SO42一
8.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA
B.78 g Na2O2中所含阴阳离子总数为3NA
C.常温常压下,22.4LCH4气体与足量Cl2反应可生成NA个CH3Cl分子
D.100mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.5NA
7.下列有关化学用语的使用正确的是
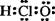 A.中子数为6的碳原子
A.中子数为6的碳原子 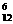 C B.次氯酸的电子式
C B.次氯酸的电子式
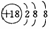
 C.硫离子结构示意图 D.CH4O的结构式
C.硫离子结构示意图 D.CH4O的结构式
33. (16分) Fe2+、SO32-和I-都具有还原性。为了比较其还原性强弱,进行以下探究并回答:
(1)已知:①还原性:SO32-> Fe2+;②FeSO3难溶于水。
(2)在(1)的基础上,完成下列假设。
假设1,还原性:I->SO32-> Fe2+;
假设2,还原性: SO32-> I- >Fe2+;
假设2,还原性: ___________________________________。
(3)实验探究:现对假设2进行探究。完成实验步骤以及预期的现象和结论。
限选以下试剂:0.1mol/L Na2SO3、0.1mol/L KI、0.1mol/L FeCl3、10%KSCN、新制饱和氯水、淀粉溶液、稀HNO3、1mol/L HCl、1mol/L BaCl2
|
实验操作 |
预期的现象及结论 |
|
步骤1:取1mL0.1mol/L Na2SO3和1mL0.1mol/L KI溶液于试管中,混合后滴入2~3滴新制氯水,振荡。 |
|
|
步骤2:____________________________ _____________________________________ |
____________________________________ _______________________________________ |
|
步骤3:取1mL0.1mol/L KI和1mL0.1mol/LFeCl2溶液于试管中,混合后滴入2~3滴新制氯水,振荡。 |
 |
 步骤4:____________________________ 步骤4:_________________________________________________________________ |
____________________________________ _______________________________________ |
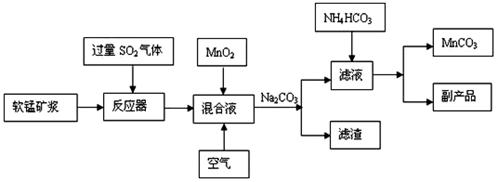
32. (16分) 高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5-7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:
已知生成氢氧化物的pH如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有 。
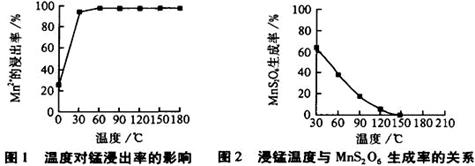
(2)由图可知,副反应MnSO4+ SO2  MnS2O6的△H 0(填>、<或=),为减少MnS2O6
的生成,“浸锰”的适宜温度是
。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6
的生成,“浸锰”的适宜温度是
。
(3)步骤②中加入MnO2和通入空气的作用 。
(4)③中控制温度为60~70℃,温度不宜太高的原因是 。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是
(写两点)。
31. (16分) 氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
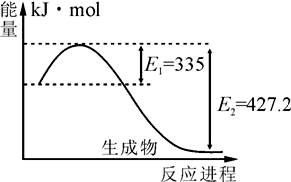
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为
;
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H<0,得到如下数据:
2NH3(g) △H<0,得到如下数据:
|
实验组 |
温度/℃ |
起始量/mol |
2分钟/mol |
平衡常数 |
|
|
H2 |
N2 |
NH3 |
|||
|
1 |
298 |
6 |
2 |
1.2 |
4.1×106 |
|
2 |
398 |
3 |
1 |
0.8 |
K1 |
请回答下列问题:
① 反应的平衡常数表达式为 ;
K1的相对大小,K1_______4.1×106(填写“>”“=”或“<”);
②实验1中以υ(H2) 表示的反应速率为 ;
③下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.υ(N2)(正) =3υ(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3) NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com