
题目列表(包括答案和解析)
36.(15分)⑴永久(1分)
⑵石灰(2分)纯碱(2分)过量的钙离子可通过纯碱使之沉淀下来(2分)
⑶H+ (1分)NaCl(1分)
⑷ ① B (2分) ② 2Cl-+2e- = Cl2↑(2分) 电极上产生无色气体,溶液中出现少量白色沉淀。(2分)
28.(14分)
(1)1 (2分) (2)K=c(z).c(w)/ c2(x).c(y)(3分)
(3)AC.
(2分) (4) (3分)
(3分)  (2分)(5)A. (2分)
(2分)(5)A. (2分)
27.(15分)⑴C (1分)在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(注意:不能加入盐酸),若反应明显加快了,说明上述推断正确。(2分)
⑵2Al+3Cu2+=3Cu+2Al3+;(2分)Al3++3H2O Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
(2分)
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
(2分)
(3)氢气(1分) ①随着反应进行生成铝离子浓度增大,水解程度增大,产生大量H+ ②该反应放热,升高温度反应加快 ③铜与铝构成原电池,加快铝失电子 (3分)
⑷AB (2分)
⑸B(2分) 电解质的性质(1分)
|
7 |
|
||||
|
A |
|
||||
|
8 |
9 |
10 |
11 |
12 |
13 |
|
D |
A |
B |
C |
C |
D |
26.(14分)
(1)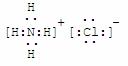 (2分) KSCN (1分)
(2分) KSCN (1分)
(2)3Fe2++NO3-+4H+= 3Fe3++NO↑+2H2O (2分)
(3)4NH3+3O2=2N2+6H2O (2分) 14 (2分)
(4)阴极:Fe3++e= Fe2+ (1分) 阳极:2Cl- - 2e= Cl2 ↑ (1分)
(5)(NH4) 2Fe(C2O4)2=FeO+2CO↑+2CO2↑+2H2O+2NH3 ↑ (3分)
(二)选考题:共45分。请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一题计分。
36、选修《化学与技术》
(15分)南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
⑴该泉水属于 硬水(填写“暂时”或“永久”)。
⑵若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加 后加 ,原因是 。
⑶目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8% 溶液中再生。
⑷岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:

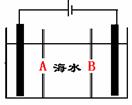


①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式: ;
阴极区的现象是: 。
37、选修《物质结构》
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为____其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 ,其中心原子的杂化方式为 。
38、选修《有机化学基础》
已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
CH3CH(OH) 2→CH3CHO +H2O
现有分子式为C9H8O2Br2的物质M,已知有机物C的相对分子质量为60,E的化学式为C7H5O2Na在一定条件下可发生下述一系列反应:

请回答下列问题:
(1)B中官能名称是 ,A的核磁共振氢谱图有 个吸收峰。
(2)M的结构简式为 _________ ;C的结构简式为 __________ 。
(3)G→H的反应类型是 ______ ;H→I的反应类型是 ______ ;
(4)写出下列反应的化学方程式:
①E→ F的化学方程式: _______ ;
②H→I的化学方程式: ___ 。
(5)请写出同时符合下列条件的G的同分异构体的结构简式 。(任写一种)
a.分子中含有苯环 b.能发生水解反应 c.能发生银镜反应 d.与FeCl3溶液反应显紫色
(一)必考题
26.(14分)已知A为一无机盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
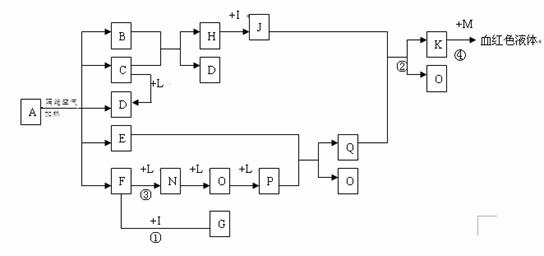
(1)写出G的电子式_______________,M的化学式_____________;
(2)写出反应②的离子反应方程式______________________________;
(3)写出反应③的化学反应方程式_____________;反应1-4中属于非氧化还原反应的是 ;
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极___________________
阳极___________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式__________________________
27.( 15分)某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是 。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择: 。
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是 。 用离子方程式解释产生气泡的原因: 。
⑶放出的气体是 ,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是 。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
|
选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
|
A |
正极 |
NaOH |
Al-3e-=Al3+ |
2H2O+2e-=2OH-+H2↑ |
|
B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
|
C |
正极 |
浓硝酸 |
Cu-2e--=Cu2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
|
D |
负极 |
稀硝酸 |
Cu-2e-=Cu2+ |
2NO3-+8H+=2NO↑+4H2O+6e- |
其中正确的是 ,由此推知,金属作电极不仅与本身性质相关,而且与
__________ 有关。
28.( 14分)在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:
2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为 。
(2)写出该反应平衡常数K的表达式 (a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是 。
A.容器内压强一定 B.容器内气体的密度一定
C.容器内Z分子数一定 D.容器内气体的质量一定
(4)X的转化率α= ,Y的平衡浓度为 。(均用含Q、Q1的代数式表示)
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
13.下列三种有机物是某些药物中的有效成分。

下列说法正确的是( )
A.三种有机物都能发生水解反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸可以鉴别这三种有机物
第Ⅱ卷(非选择题,共174分)
12.下列各溶液中,有关成分的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4溶液,(NH4)2Fe (SO4)2溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl)
11.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A.X的氢化物溶于水显酸性 B.X与Y形成化合物的化学式为X2Y2
C.Y的氧化物是离子化合物 D.X和Z的最高价氧化物对应水化物都是弱酸
10.可逆反应mA(s)+nB(g) pC(g)+qD(g)反应过程中,当其他条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。
pC(g)+qD(g)反应过程中,当其他条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。

下列叙述正确的是( )
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>p+q
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com