
题目列表(包括答案和解析)
7.香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法不正确的是
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化 物对应的水化物碱性:X>Y>Z
物对应的水化物碱性:X>Y>Z
D.XR2、WR2两化合物中R的化合价相同

 不定项选择题:本题包括7小题,每小题4分,共计28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
不定项选择题:本题包括7小题,每小题4分,共计28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
6.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选; ②焙烧:2PbS+3O2
 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。下列说法正确的是
Pb+CO2。下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
 D.将1molPbS冶炼成Pb理论上至少需要6g碳
D.将1molPbS冶炼成Pb理论上至少需要6g碳
5.下列各组离子,一定能在指定环境中大量共存的是
A.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+
B.在使pH试纸变红的溶液中:Fe2+、Na+、SO42-、ClO-
C.在由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、Cl¯、Br¯
D.在加入Al能放出大量H2的溶液中:NH4+、SO42¯ 、C1¯、HCO3¯
4. 下列装置或操作不能达到实验目的的是
下列装置或操作不能达到实验目的的是
A.实验室制取并收集NH3 B.构成原电池 C.检查装置气密性 D.实验室制备乙烯
3.设NA为阿伏加德罗常数,下列叙述中正确的是
A.在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA
B.常温常压下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA
C.标准状况下,1 L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4
D.0.1L 2mol·L-1的(NH4)2S溶液中含有的S2-数目为0.2 NA
2. 下列有关说法或表示正确的是
下列有关说法或表示正确的是
A.2一甲基苯酚结构式:
B.碳化钙的电子式:Ca2+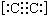 2-
2-
C.铁在潮湿的空气中腐蚀,正极的电极反应式:Fe-2e-=Fe2+
D.18 8O2-粒子结构示意图: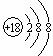
1.温家宝总理在2010年政府工作报告中提出,要大力开发低碳技术,推广高效节能技术。下列有关做法与此不相符的是
A.关停CO2排放量大的化工企业,切断CO2的源头
B.利用工业生产产生的二氧化碳制造全降解塑料
C.开发新能源,如太阳能、风能等,减少对化石能源的依赖
D.鼓励购买小排量汽车,推广电动、混合动力汽车
28.(14分)有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为: 。
。
按图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。

图
已知:
① -CH2OH
+ -CH2OH
 -CH2OCH2- + H2O
-CH2OCH2- + H2O
②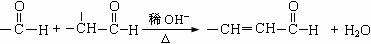
回答下列问题:
(1)试剂Ⅰ的名称是 ;B→C的反应类型是 ;
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为 。
(3)写出下列反应的化学方程式。
①D→E的反应 ;②C与F的反应 。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为 。
27.(15分)煤的气化是高效、清洁地利用煤炭的重要途径之一。
(1)在25℃、101kPa时,H2与O2化合生成1 mol H2O(g)放出241.8kJ的热量,其热化学方程式为 。
又知:①C(s)+ O2 (g) ==== CO2 (g) ΔH =-393.5 kJ/mol
②CO(g) + 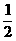 O2 (g) ==== CO2 (g) ΔH = -283.0 kJ/mol
O2 (g) ==== CO2 (g) ΔH = -283.0 kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s) + H2O(g) ==== CO(g) + H2(g) ΔH = kJ/mol。
(2)CO可以与H2O(g)进一步发生反应:CO(g) + H2O(g)  CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。
|
起始物质的量 |
甲 |
乙 |
丙 |
|
n(H2O)/
mol |
0.10 |
0.20 |
0.20 |
|
n(CO)/
mol |
0.10 |
0.10 |
0.20 |
①该反应的平衡常数表达式为 。
②平衡时,甲容器中CO的转化率是 ;
容器中CO的转化率:乙 甲;丙 甲。(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度 (填“升高”或“降低”)。
26.(14分)某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去。
提供的试剂:研细的钙片粉末(钙片中的其他成分不与盐酸反应)、2mol/L 盐酸、5%NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液和蒸馏水。
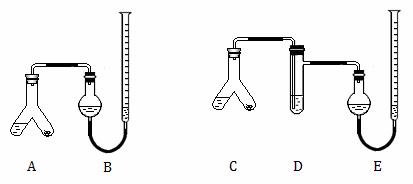
图1 图2
实验过程:
I.检查两套装置的气密性。
II.在A、C的右边加入0.25 g钙片粉末,左边加入3 mL 2mol/L盐酸,塞紧塞子。在B、E中均加入饱和NaHCO3溶液,如图所示,记下量气管读数。
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得 B中收集到的气体为41.90 mL,E中收集到的气体体积为39.20 mL(以上气体体积均已折算为标准状况下的体积)。
回答下列问题:
(1)I中检查图1装置气密性的方法是 。
(2)A中发生反应的离子方程式为 ;D中加入的试剂为 。
(3)实验前左右两管液面在同一水平面上,最后读数时右管的液面高于左管的液面,
应进行的操作是 。
(4)图2实验所得钙片中的碳酸钙的质量分数为 ;图1实验比图2实验所得
钙片中的碳酸钙含量偏高,用离子方程式表示偏高的原因: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com