
题目列表(包括答案和解析)
7. 下列叙述正确的是( )
A.明矾和ClO2常用于自来水的净化和杀菌消毒,两者的反应原理相同。
B.盛放KOH溶液的试剂瓶不能用橡胶塞,应该用玻璃塞。
C.北京时间3月11日日本发生9.0级地震,引起核泄漏,产生的粉尘中含有较多的131I,这是一种质子数为131的有放射性的碘的一种核素。
D.冰岛和印度尼西亚火山喷发,火山灰在空气中几周都不能沉降,可能与胶体的性质有关。
38、
肉桂醛在食品、医药化工等方面都有重要应用。
(1)下列是合成肉桂醛、制备肉桂酸的反应路线:
|
|
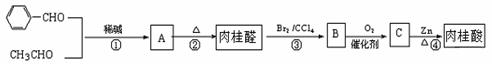
实验表明:
Ⅰ. A既能发生银镜反应,又能与金属钠反应放出氢气;
Ⅱ. 肉桂醛的相对分子质量不超过140,其中碳氢元素质量分数为87.89%。
Ⅲ. 核磁共振氢谱表明肉桂醛分子中有六种氢,其峰面积之比为1:1:1:2:2:1;
(1)A中含有的官能团为
(2) 请写出肉桂醛的结构简式。
----------------------------
(3) 已知反应①的原子利用率为100%,请写出第①步的化学反应方程式。
(4)反应(1)的反应类型 反应(2)的反应类型为
(5) 请写出上述合成路线中使用③④两步反应的目的。
(6)写出反应⑤的化学方程式 。
(7) 请写出与肉桂醛互为同分异构体,且同时满足 a.分子中无甲基,b.所有碳原子一定在同一平面上c、苯环上一氯代物只有两种的有机物的结构简式。
37、(15分) 有A、、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子, 比
比 少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的 (填序号)。
① 单质>B单质>R ②R>A单质>B单质
③ 单质>R>A单质 ④A单质>R>B单质
(2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为 。
 (3)写出D原子的核外电子排布式
_,C的氢化物比D的氢化物在水中溶解度大得多的可能原因
。
(3)写出D原子的核外电子排布式
_,C的氢化物比D的氢化物在水中溶解度大得多的可能原因
。
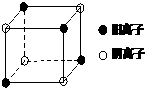
(4)右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为 ,FeD2物质中具有的化学键类型为 。
36、
(15分)自然界中进行着氮元素的循环,所以空气中氮气的含量基本保持不变。
(1)植物生长所需的主要的三种营养元素为 ,由氮气转变成氮的化合物的
过程叫做
(2)农谚有“一场雷雨一场肥”的说法,其中的“肥”是雷雨形成的最终产物之一,
 其化学式是
其化学式是
(3)已知 +
+ 青 2
青 2 ;
; H=180.74KJ/mol.此反应称为伯克莱特-艾,
H=180.74KJ/mol.此反应称为伯克莱特-艾,
某次雷雨闪电中两块云间的电势差为1× V,从一块云移到另一块云的电荷量为30000C,此次闪电释放出的能量为 KJ .
V,从一块云移到另一块云的电荷量为30000C,此次闪电释放出的能量为 KJ .
(4) 若该闪电有千分之一的能量用来产生NO,则可生成NO mol,雷雨的生成物相当于
给大地施加尿素 t
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。

请回答:
③ 写出仪器(1)与仪器(3)的名称
(1) (3)
④ 为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤ 如何准确读出量筒中气体的体积
a________ _
b 上下移动量筒至量筒内液面与水槽液面相平
c
28、二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境
化学当前的重要研究内容之一。
(1) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,其吸收的化学反应方程式为 再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(2) 工业上生产硫酸时,将SO2氧化为SO3是关键一步。
① 某温度下,SO2(g)+1/2O2(g)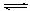 SO3(g);△H= -98 kJ· mol-1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。
SO3(g);△H= -98 kJ· mol-1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。
② 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)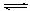 2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
 A、保持温度和容器压强不变,充入2mol SO3
A、保持温度和容器压强不变,充入2mol SO3
B、保持温度和容器体积不变,充入2mol N2
C、保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D、升高温度
E、移动活塞压缩气体
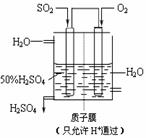
(3) 某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极的电极为 极; 写出通入SO2的电极的电极反应式: 。
28.(16分)
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂。它的结构简式如右图所示,请回答:
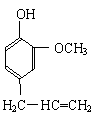 ⑴ A的分子式是______________。
⑴ A的分子式是______________。
⑵ 有机物A不能发生的化学反应有(填序号)____________。
a.加成反应 b.消去反应
c.加聚反应 d.氧化反应
⑶ 满足下列条件的A的同分异构体有_____种,写出其中一种的结构简式________。
①能与碳酸氢钠溶液反应; ②核磁共振氢谱显示有四种类型氢原子的吸收峰
 ⑷ 已知:
⑷ 已知:
ⅰ.

①试剂I可以选用的是(填字母)____________;
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na2CO3溶液
②上述转化过程中,设置步骤M→N的目的是____________;
③写出P生成Q的化学方程式____________________________________;
④P与乙二酸在一定条件下可发生反应生成高分子化合物W,写出W的结构简式________________________。
昌平区2010-2011学年第二学期高三年级第二次统一练习
27.(13分)
 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
⑴ 步骤Ⅰ的目的是除不溶性杂质。所需操作的名称是____________。
⑵ 步骤Ⅱ的目的是除硫酸亚铁。操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①写出用H2O2溶液除去硫酸亚铁的离子方程式________________________。
②调整pH 的范围应该在____________之间。
⑶ 步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是将溶液加热蒸发至有晶膜出现时,停止加热,____________,水浴加热烘干。采用水浴加热的原因是______。
⑷ 该同学用CuSO4溶液进行如下探究实验:
取A、B两支试管,分别加入 2 mL 5% H2O2溶液,再向H2O2溶液中分别滴入 0.1 mol·L-1 FeCl3和CuSO4 溶液各1 mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确___________(填正确或错误),请说明原因___________。
26.(14分)
A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
⑴ D在元素周期表中的位置是______。
⑵ 由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______。
⑶ D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为______;若有1 mol电子转移,生成Z的物质的量为______mol。
⑷ 写出实验室制备BA3的化学方程式________________________。将BA3 通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式______。
⑸ 已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池负极反应是________________________。以石墨为电极,用该电池电解100 mL饱和食盐水,一段时间后,在两极共收集到224 mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)________。
25.(15分)铁元素及其化合物与人类的生产生活息息相关,回答下列问题
⑴ 铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+。
①铁酸钠中铁元素的化合价为_____。
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:______。(用离子方程式表示)
 ⑵ 反应ⅠFe(s)+CO2(g)
FeO(s)+CO(g) △H=a kJ・mol-1,平衡常数为K;
⑵ 反应ⅠFe(s)+CO2(g)
FeO(s)+CO(g) △H=a kJ・mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g) △H=b kJ・mol-1
测得在不同温度下,K值如下:
|
温度/℃ |
500 |
700 |
900 |
|
K |
1.00 |
1.47 |
2.40 |
①写出K的表达式__________________。
②反应Ⅰ中的a____________0(填大于、小于、等于)。
③若500℃时进行反应Ⅰ,CO2起始浓度为2mol・L-1,CO的平衡浓度为____________mol・L-1。
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有____________(填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=______kJ・mol-1。
⑶ 铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______g。
12. 下列反应所得溶液中一定只含一种溶质的是
A.向AlCl3溶液中加入过量NaOH溶液 B.向NaOH溶液中通入CO2气体
C.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液
D.向NaHCO3溶液中加入CaC2固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com