
题目列表(包括答案和解析)
1.每年的6月5日是“世界环境日”,今年世界环境日主题是“促进低碳经济”, 来自全球192个国家的谈判代表,召开《联合国气候变化框架公约》第15次缔约方会议,商讨2012年至2020年的全球减排协议。下列行为中不符合“促进低碳经济”宗旨的是( )
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖;
B.限制化学发展,关停化工企业,消除污染源头;
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值;
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气;
(二)选考题:
36. [化学--选修化学与技术](15分)
(1)①10NH4NO3 3H2O (2分) ②Ca5(PO4)3OH↓+ 9H2O(2分)
(2)唯一副产物为水,工艺简单(3分) (3)反应液局部酸性过大,会有CaHPO4产生(3分)
(4)Ca5(PO4)3OH(2分)
(5)酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s)  5Ca2+(aq)
+ 3PO43-(aq)+OH-(aq)向右移动,导致
5Ca2+(aq)
+ 3PO43-(aq)+OH-(aq)向右移动,导致
Ca5(PO4)3OH溶解,造成龋齿(3分)
37. [化学--选修物质结构与性质](15分)(除注明分值外,其他每空均为2分)
(1)1s22s22p63s23p63d104s24p2 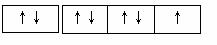
3s 3p
(2)共价键
(3)(3分)正四面体形 sp3杂化 非极性分子
(4)范德华力
(5)GeCl4 二者结构相似,GeCl4相对分子质量大,分子间作用力强,沸点高
38. [化学--选修有机化学基础](15分)
(1)CH2(COOH)2 (2分) (2) e (2分) (3)3:2:3 :2(2分)
(4)(3分)
(5)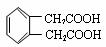 (3分)
(3分)
(6) 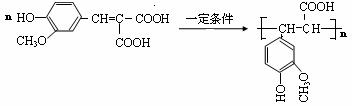 (3分)
(3分)
(二)选考题:共45分,请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。如果多做,则每学科按所做的第一题计分。
36. [化学--选修化学与技术](15分)
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
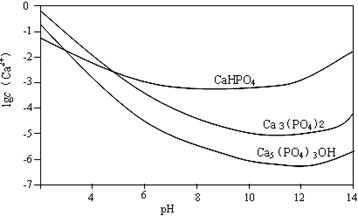
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5 Ca(NO3)2 + 3(NH4)2HPO4 + 4NH3·H2O = Ca5(PO4)3OH↓+ + (2分)
②5Ca(OH)2 + 3H3PO4 = (2分) (2)与方法A相比,方法B的优点是 。(3分)
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是 。(3分) (4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。(2分) (5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因 。(3分)
37. [化学--物质结构与性质](15分)
已知和碳元素同主族的X元素位于周期表中的第一长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为 ;Y元素原子最外层电子的轨道表示式为 。
(2)若X、Y两元素电负性分别为1.8和3.0,则XY4中X与Y之间的化学键为 (填“共价键”或“离子键”)。
(3)该化合物的空间结构为 ,中心原子的杂化类型为 ,分子为 (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该化合物中分子间作用力是 。
(5)该化合物的沸点与SiCl4比较, (填化学式)的较高,原因是 。
38. [化学--选修有机化学基础](15分)
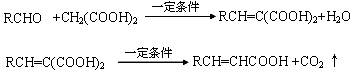 已知:
已知:
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)
A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体。
(1)A的结构简式是________________。
(2)在中学学过知识里 B不可能发生的反应是________ (填序号)
a、取代反应 b、加成反应c、氧化反应d、 还原反应e、水解反应 f、显色反应
(3)等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是________________
(4)写出C与足量的Na2CO3的化学方程式为:_________________________________________________
(5)写出符合下列条件的阿魏酸所有的同分异构体的结构简式: 。
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种; ③1mol该同分异构体与足量NaHCO3反应生成2mol CO2气体;
④该同分异构体进行核磁共振氢谱分析发现只有4种峰。
(6)写出利用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
___________________________________________________________________________。
理综答案
第Ⅰ卷 一、选择题:每小题6分
7.D 8.C 9.D 10.C 11.A 12.B 13.C
第Ⅱ卷:三、非选择题:(一)必考题
26.(14分)Ⅰ.Cu2+ + CO32- == CuCO3 ↓(2分) Cu2+ + CO32- + H2O == Cu(OH)2 ↓+CO2 ↑(2分)
Ⅱ.普通漏斗(只写漏斗不给分)(2分);C(2分)
Ⅲ.CuCO3 和Cu(OH)2均有(2分)
Ⅳ.(1)C→A→B→D→E(D、E互换也给分)(2分) (2)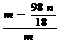 (2分)
(2分)
27.(14分,每空2分)(1)Al2O3 (2)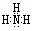 ,
, 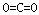
(3)C(Na+)>C(SO42-)>C(NH4+ )>C(H+)= C(OH-)
(4)白天有太阳Na2CO3·10H2O分解吸热,晚上H2O和Na2CO3再结合成晶体放热,可以调节温度。
(5)CO2 +NaAlO2+2H2O===Al(OH)3↓+ NaHCO3
(6)NH4+ +H++2OH-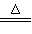 NH3↑ +2H2O(若H+写成HSO4-配平了也可以)
NH3↑ +2H2O(若H+写成HSO4-配平了也可以)
28.(15分)
(1).1;>(各1分,共2分) (2).ABC(2分) (3).A (2分),ABC(2分)
(4).1.5Q KJ(2分) (5).N , > (各1分,共2分) (6).300℃。(3分)
(一)必考题(共11题,共129分)
26.(14分)实验事实:某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中结果得到蓝色沉淀。
Ι.甲同学认为:CuCO3是难溶解的物质,两者反应只有CuCO3一种沉淀生成;
乙同学认为: CO32-和Cu2+两者相互促进,发生水解反应,只生成Cu(OH)2一种沉淀;
丙同学认为:两种因素都有存在,应生成CuCO3和Cu(OH)2两种沉淀。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水].用离子方程式表示甲乙同学的观点
甲同学
乙同学
Ⅱ.在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为:①过滤②洗涤③干燥。
过滤除了使用铁架台、玻璃棒、烧杯外,还要用到的玻璃仪器是:_______;洗涤后的沉淀应____(选填下列序号)干燥:
A.在干燥管中 B.在U型管中 C.在干燥器中 D.在装有浓硫酸的洗气瓶中 E.在坩埚中微热
Ⅲ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
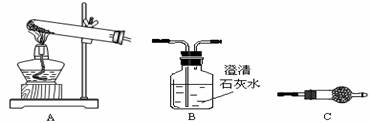
各装置连接顺序为A →C→B。装置C中装有试剂无水硫酸铜,若C中无水硫酸铜变蓝,澄清石灰水变浑浊,说明生成的沉淀的成分是: (写化学式)。
Ⅳ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
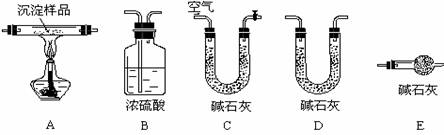
⑴各装置的仪器连接顺序是 (按照气体流向从左往右用字母表示)。
⑵ 若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为: (只列计算式)。
27.(14分)现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种强酸的酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答:
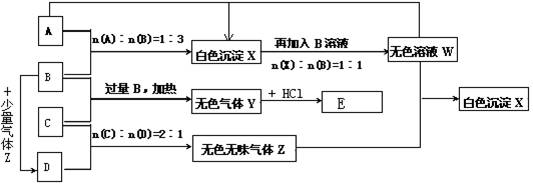
(1)将A溶液蒸干并灼烧得到的固体是: (写化学式)。
(2)Y的电子式是 ,Z的结构式是 。
(3)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序: 。
(4)有人设想在适当大小的管道中填充一定量的D的晶体(摩尔质量在280∽300之间),管道环绕在一个房子的周围,这样的房子白天晚上室内温度可保持相对恒定,请简述其原理: 。
(5)写出过量的Z与W反应生成X的化学方程式 。
(6)写出C与过量B反应(加热)的离子方程式 。
28.(15分)在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:
2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)、化学计量数a的值为 ;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)、下列说法中能说明该反应达到了化学平衡状态的是 。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)、维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应);与之是等效平衡的是______________。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)、维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为 kJ。
(5)、维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
(6)已知:该反应的平衡常数随温度的变化如下表:
|
温度/℃ |
150 |
200 |
250 |
300 |
350 |
|
平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
13.下列各表述与示意图一致的是( )
若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加
NaOH溶液时,沉淀的量与NaOH的体积的关系图。
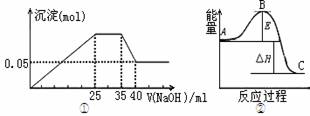 A.图①三种离子的物质的量之比为:
A.图①三种离子的物质的量之比为:
n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B.图①中使用的NaOH的浓度为2mol/L
C.图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
D.图②中物质A反应生成物质C,△H>0;
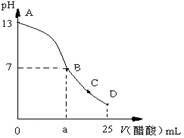
12. 25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析正确的是
A.B点的横坐标a=12.5
B.D点时溶液中有:C(CH3COO-)+C (CH3COOH)=2 C (Na+)
C.C点时溶液中有:C (Na+)> C (CH3COO-) > C (H+)> C (OH-)
D.曲线上A、B间的任意一点,溶液中都有:C(CH3COO-)> C (Na+)> C(OH-)> C(H+)
11.关于下列装置说法正确的是( )
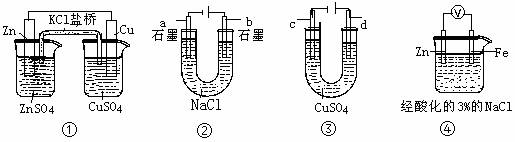
A.装置①中,盐桥中的Cl-移向ZnSO4溶液 B.装置②工作一段时间后,b极附近溶液的pH增大
 C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
10. 200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为( )
A.5.8 B.11.6 C.23.2 D.46.4
9.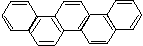 右图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃,下列说法正确的是( )
A.该有机物属于苯的同系物
B.该有机物的一氯代物有一种
C.该有机物属于苯的衍生物
D.该有机物完全燃烧生成H2O 的物质的量小于CO2的物质的量
右图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃,下列说法正确的是( )
A.该有机物属于苯的同系物
B.该有机物的一氯代物有一种
C.该有机物属于苯的衍生物
D.该有机物完全燃烧生成H2O 的物质的量小于CO2的物质的量
8.在一定条件下,等物质的量的氯气与碘单质反应,得到一种红棕色液体ICl,ICl有很强的氧化性。现有下列两个反应:①2ICl+2Zn==ZnCl2+ZnI2 ②ICl+H2O===HCl+HIO。下列叙述正确的是( )
A.C12与I2生成ICl是非氧化还原反应
B.反应①中,ZnI2只是氧化产物
C.反应①中,当转移0.4mol电子时生成13.6g ZnCl2
D.反应②中,ICl既是氧化剂又是还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com