
题目列表(包括答案和解析)
20. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H=-192.9kJ·mol-1
下列说法正确的是
A.根据反应①,64gCH3OH完全燃烧放出的热量为98kJ
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程不一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
第Ⅱ卷 非选择题(共44分)
19.下列性质中,属于烷烃特征性质的是
A.完全燃烧的产物为二氧化碳和水
B.它们几乎不溶于水
C.它们是非电解质
D.分子的通式为CnH2n+2,光照条件下能与氯气发生取代反应
18.下列实验操作与实验目的相符的是
|
序号 |
实验操作 |
实验目的 |
|
A |
测定HF、HCl的熔点、沸点 |
比较F、Cl的非金属性强弱 |
|
B |
MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 |
比较镁、铝的金属性强弱 |
|
C |
将SO2气体通入碳酸钠溶液中 |
比较碳、硫的非金属性强弱 |
|
D |
向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 |
比较NaOH、NH3·H2O、Al(OH)3的碱性 强弱 |
17.含有2-5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
|
烷烃名称 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
|
沸点(℃) |
-88.6 |
-42.1 |
-0.5 |
36.1 |
|
*燃烧热(kJ·mol-1) |
1560.7 |
2219.2 |
2877.6 |
3535.6 |
* 燃烧热:1 mol物质完全燃烧,生成二氧化碳、液态水时所放出的热量。
根据表中数据,下列判断错误的是
A.正庚烷在常温常压下肯定不是气体
B.直链烷烃所含碳原子数越多则其燃烧热就越大
C.随着烷烃中碳原子数增加,烷烃的沸点逐渐降低
D.随着烷烃中氢元素的质量分数增大,烷烃的燃烧热逐渐增大
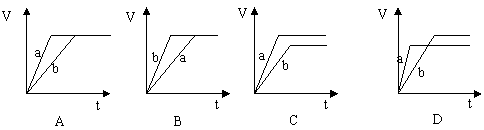
16.等质量的两份锌粉a和b,分别加入过量的稀硫酸中,并向a中加入少量CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系正确的是
15.一定温度下,在容积不变的密闭容器中充入l mol N2和3 mol H2,发生合成氨反应,t分钟后达到平衡状态。下列有关说法正确的是
A.达到化学平衡状态时,容器中将生成2molNH3
B.t分钟后,只要条件不变,容器内各气体的浓度就不再变化
C.t分钟内,v(N2)=v(H2)=v(NH3)
D.达到化学平衡状态时,正反应和逆反应的速率相等,且均等于0
14.下表给出几种氯化物的熔沸点:
|
|
NaCl |
MgCl2 |
CaCl2 |
SiCl4 |
|
熔点(℃) |
801 |
712 |
782 |
-68 |
|
沸点(℃) |
1465 |
1418 |
1600 |
57 |
对此有下列说法与表中数据一致的说法有
A.CaCl2晶体中的离子键比MgCl2晶体中的离子键强 B.SiCl4是分子晶体
C.801℃时,NaCl可形成气态 D.MgCl2水溶液不能导电
13.下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应是放热还是吸热
D.吸热反应在一定条件下也能发生反应
12.在2 L密闭容器中,发生3A(g)+B(g) 2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10 s后容器中B的物质的量浓度是
2C(g)的反应,若最初加入A和B都是4 mol,A的平均反应速率为0.12 mol·L-1·s-1,则10 s后容器中B的物质的量浓度是
A.1.4 mol·L-1 B.1.6 mol·L-1 C.1.8 mol·L-1 D.3.2 mol·L-1
11.查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com