
题目列表(包括答案和解析)
20.(20分)
20-I(6分)下列化工生产过程中,需用到电解食盐水产物的是 ( )
A.工业生产纯碱 B.金属铝的冶炼
C.海水中提取溴 D.工业生产玻璃
20-II(14分)利用磷肥生产中形成的副产物石膏(CaSO4·2H2O)生产硫酸,同时得到硫酸钾肥料和氯化钙水合物储热材料,无论是从经济效益、资源综合利用还是从环境保护角度都具有重要意义。以下是有关的工艺流程示意图。
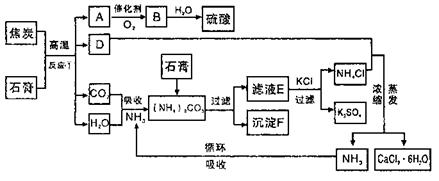
请回答下列问题:
(1)反应①的化学方程式是 ;
(2)沉淀F含有 (填化学式)等物质,可作为生产水泥的主要原料;
(3)检验滤液E中含有CO2-3的方法是 (用简要文字回答);
(4)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,主要选择的依据是 (填序号)
a.能导电 b.易溶于水 c.熔点较低(29℃熔化) d.无毒
(5)工业制硫酸的精制炉气中,SO2平衡转化率与温度及压强关系如下表:
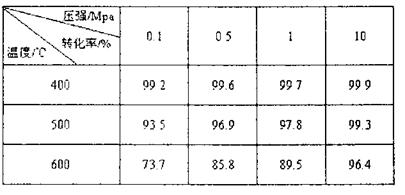
分析上表数据,你认为工业上制硫酸中SO2的催化氧化的适宜条件是 。
19.(20分)
19-I(6分)下列叙述中正确的是 ( )
A.SO2-3的空间构型为平面三角形
B.SiO2晶体中,最小的环上有6个Si原子和6个O原子
C.CuSO4·5H2O中Cu的配位数为4
D.SnBr2分子中Sn-Br的键角为120°
19-II(14分)A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大。A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2。
请回答下列问题:
(1)E是元素周期表中第 周期,第 族的元素;
(2)A、B、C三种元素中,电负极最大的是 (填元素符号);
 (3)A与C两种元素可形成分子式为AC2的共价化合物,
(3)A与C两种元素可形成分子式为AC2的共价化合物,
其分子的立体结构是 ,由A、B、C形成的
离子CAB-与AC2互为等电子体,CAB-中A原子的
杂化方式是 ;
(4)由A、D、E三种元素形成的一种晶体具有超导性,
其晶胞结构如右图所示。该晶体的化学式为 ;
该晶体中每个D原子周围距离最近的E原子有 个;
(5)E的单质粉末在AC气流中轻微加热,生成无色挥发性液诚物质E(AC)4,E(AC)4呈四面体构型。在423K时,E(AC)4分解为单质E和AC,从而制得高纯度的单质E粉末。则E(AC)4的晶体类型是 ;E(AC)4易溶于 (选填序号)。
①水 ②四氯化碳 ③苯 ④硫酸镍溶液
18. (20分)
(20分)
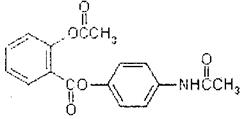
18-I(6分)新型解热镇痛抗炎药扑炎痛的结构如图所示,
下列关于扑炎痛的叙述正确的是 ( )
A.该物质的分子式为C17H16NO5
B.该物质的核磁共振氢谱上共有9个峰
C.该物质与溴水反应生成白色沉淀
D.该物质在酸性条件下水解最终可以得到3种物质
18-II(14分)E(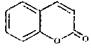 )是一种用途广泛的香料,其合成路线如下图:
)是一种用途广泛的香料,其合成路线如下图:

已知在碱性条件下,两个醛分子能发生如上反应:
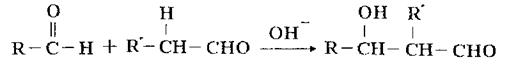
请回答下列问题:
(1)有机物A的分子式为C7H6O2,遇FeCl2溶液显紫色,能发生银镜反应,则有机物中含有的官能团名称为 ;
(2)试剂X的结构简式为 ;
(3)由B转化为C的反应类型是 ;
(4)由D直接生成香料E的化学反应方程式为 ;
(5)检验香料E中含有碳碳双键的方法是 ;
(6)写出符合下列条件B的同分异构体的结构简式 (写出一种即可)。
①苯环上有两个取代基; ②能和NaHCO3溶液反应产生气泡;
③1molB与2molNaOH溶液反应; ④苯环上的一氯取代物只有两种
17.(10分)二甲醚(CH3OCH4)是一种重要的清洁燃料,工业上利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH(g)+H2O(g) △H=-23.5kJ·mol-1
CH3OCH(g)+H2O(g) △H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3kJ·mol-1
CO2(g)+H2(g) △H=-41.3kJ·mol-1
请回答下列问题:
(1)利用水煤气合成二甲醚的热化学反应方程式为 ;
(2)以二甲醚为燃料,硫酸为电解质溶液可制成二甲醚燃料电池。该电池负极的电极反应为
;
(3)已知某二甲醚燃料电池的总反应为
CH3OCH3(g)+3O2(g)+4OH-(ag)=2CO2-3(aq)+5H2O(l)△H=-akJ·mol-1
该电池工作一段时间后,生成1mol液态水时释放bkJ电能,则电池的能量转化率为 ;
(4)用上述燃料电池电解NaHSO3溶液(惰性电极)的装置如右图所示。

①阴极的电极反应为 ;
②阳极区放出气体的成分为 (填化学式)。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
第18、19、20三题的第I题为选择题,在给出的四个选项中,至少有两项是符合题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第II题为非选择题,请在答题卡相应位置做答并写明小题号。
16.(8分)A~F的转化关系如下:

请回答下列问题:
(1)有机物A的相对分子质量为90,9.0gA和足量的金属Na反应,在标准状况下能生成2.24L的H2,则A的分子式为 ;
(2)C的结构简式为 ,由E生成F的反应类型是 ;
(3)写出由D直接生成E的化学方程式为 ;
(4)写出与A具有相同官能团的A的同分异构体的结构简式 。
15.(8分)A~G各物质间的关系如下图,其中A是发酵粉的主要成分,C、F常温常压下是气体,E是淡黄色固体。

请回答下列问题:
(1)A的俗名是 ,G的电子式是 ;
(2)反应②的化学方程式是 ;
(3)鉴别A、B两物质水溶液的常用试剂是 ;
(4)C是一种常见的温室气体,在自然界循环时可与CaCO3反应。CaCO3是一种难溶物质,其KSP(CaCO3)=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 mol/L。
14.(10分)为测定某镁铝合金样品(不含其它杂质)中镁的质量分数,某化学兴趣小组的同学设计了如下主要实验步骤:
①粉碎:将镁铝合金样品粉碎,称得样品质量m1g
②溶解:将粉碎后的样品浸泡在过量NaOH溶液中溶解
③称重:过滤、洗涤、干燥,称得残渣质量m2g
④恒重:……
请回答下列问题:
(1)铝镁合金与过量NaOH溶液反应的化学方程式为 ;
(2)过滤时所需的玻璃仪器有玻璃棒、烧杯和 ;过滤时发现滤液中有少量浑浊,从实验操作的角度分析可能的原因的是____ ;(写两种原因);
(3)实验中,说明样品已经恒重的实验依据是 ;
(4)实验中,测得镁铝合金样品中镁的质量分数为____ ;
(5)还可以通过测定反应生成气体的体积达到实验目的。请选用下列实验装置,设计一个最简单的实验测定m1g样品中镁的质量分数。
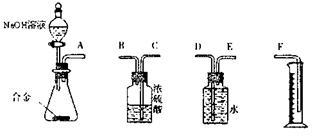
你认为装置的连接顺序是A (填字母序号)。
13.(8分)某混合物M由Cu、Al2O3、SiO2、Fe2O3中的一种或几种物质组成。现进行如下实验:
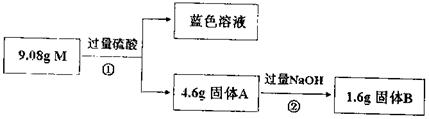
回答下列问题:
(1)经①得到蓝色溶液,该过程一定发生的化学反应是 (用离子方程式表示);
(2)反应②的化学方程式是 ;
为进一步测定混合物M的成分,又进行了如下实验:
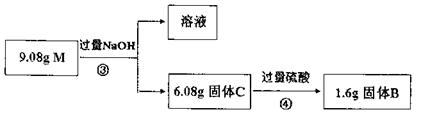
(3)上叙两个实验说明了混合物M是由 物质组成,其质量之比为 (不必化简)。
12.已知某温度下反应2A(s)+3B(g) 3C(g)+D(s)△H<0的平衡常数为64。此温度下,在一个容积为2L的密闭容器中加入A、B、C、D各2.0mol,10min后反应达到平衡。下列说法正确的是 ( )
3C(g)+D(s)△H<0的平衡常数为64。此温度下,在一个容积为2L的密闭容器中加入A、B、C、D各2.0mol,10min后反应达到平衡。下列说法正确的是 ( )
A.该反应的平衡常数表达式为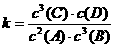
B.升高温度,该反应的平衡常数增大
C.从反应开始10min,该反应的平均反应速率v(C)为0.12mol/(L·min)
D.B的平衡转化率为60%
第Ⅱ卷(非选择题,共64分)
本卷包括必考题和选考题两部分。第13题~第17题为必考题,每个试题考生都必须做答。第18题~第20题为选考题,考生根据要求做答。
11.下列除去杂质的方法正确的是 ( )
A.除去KNO3晶体中少量NaCl:加水溶解,蒸发结晶
B.除去CO2中混有的少量SO2:用饱和Na2CO3溶液洗气
C.除去Fe(OH)3固体中少量Mg(OH)2:加入足量饱和FeCl3溶液,充分搅拌后过滤
D.除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com