
题目列表(包括答案和解析)
15.下列离子方程式正确的是
A.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42ˉ恰好完全反应:
2Ba2++4OH-+Al3++2SO42-→BaSO4↓+AlO2-+2H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+CO32ˉ+H2O→2HCO3ˉ
D.向Fe2(SO4)3溶液中加入过量Na2S溶液:2Fe3++3S2-→2FeS↓+S↓
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
14.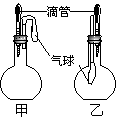 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大。则所用试剂分别可能依次是
在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大。则所用试剂分别可能依次是
A.甲:浓硫酸和木炭 乙:浓氨水和SO2
B.甲:双氧水和MnO2 乙:饱和食盐水和HCl
C.甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2
D.甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢
13.一定温度下,测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法一定正确的是
A.溶液中四种粒子之间满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中粒子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质为:NH3·H2O和NH4Cl。
C.若溶液中粒子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质只有NH4Cl。
D.若溶液中c(NH4+)= c(Cl-),则该溶液pH等于7。
12.下列微粒在溶液中能大量共存的是
A.NH4+、Mg2+、SO42-、CH3COO- B.HCO3-、K+、Cl-、AlO2-
C.Cu2+、Na+、SO42-、HS- D.Na+、H+、SO42-、S2O32-
10.下列有关化学键与晶体结构说法正确的是
A.两种元素组成的分子中一定只有极性键
B.含有阴离子的化合物一定有阳离子
C.非金属元素组成的化合物一定是共价化合物
D.离子化合物的熔点一定比共价化合物的高
|
 11.如图表示反应2SO2(g)+O2
11.如图表示反应2SO2(g)+O2  2SO3(g)+Q的正反应速率随时间的变化情况,试根据右图曲线判断下列说法可能正确的是
2SO3(g)+Q的正反应速率随时间的变化情况,试根据右图曲线判断下列说法可能正确的是
A.t1时只减小了压强;
B.t1时只降低了温度;
C.t1时增加了SO2和O2的浓度,平衡向正反应方向移动;
D.t1时减小SO2浓度的同时,增加了SO3的浓度;
9. 按右图所示进行实验,以下叙述正确的是
按右图所示进行实验,以下叙述正确的是
A.离子交换膜既能让Na+通过,又能让OH-通过
B.阳极产生氯气和氢氧化钠
C.阴极区要定时添加饱和食盐水
D.阴极区流出的是氢氧化钠和氯化钠的混合溶液
8.下列说法正确的是
A.乙烯和聚乙烯都能使溴水褪色
B.用新制的氢氧化铜浊液不能检验淀粉和纤维素是否发生了水解
C.油脂的水解反应,都是皂化反应
D.橄榄油、茶籽油和花生油等都能使溴水褪色
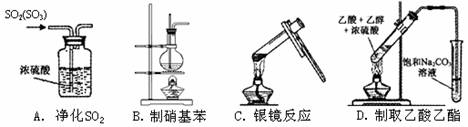
7.下列装置或操作正确的是
6.用NA表示阿伏加德罗常数,下列叙述正确的是
A.含0.1molHCl溶液中含氢元素0.1NA
B.22.4 L 水蒸气含原子数为3NA
C.3.4g H2O2中含有的共用电子对数为0.1 NA
D.标准状况下,1mol辛烷含有的氢原子数为18NA
5.随着人类对原子结构的不断认识,科学家和他们提出的原子结构模型对应的是
A.道尔顿-葡萄干面包模型 B.卢瑟福-行星模型
C.汤姆逊-电子轨道模型 D.居里夫人-量子力学模型
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com