
题目列表(包括答案和解析)
1.2004年诺贝尔化学奖授予美国和以色列的三位科学家,以表彰他们在蛋白质降解的研究中取得的成果。下列关于蛋白质的说法中不正确的是( )
A.蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命
B.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
C.某些蛋白质跟浓硝酸作用会变黄
D.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
2.5*10-22*6.02*1023 = 150.5
14.∵ 1个该原子的质量:
M= p v
= 5.0g∕cm¯3(10¯7cm *)/20
=2.5*10-22
∴该元素的相对原子量为:
13.[CoCl(NH3)4(H2O)]Cl2 二氯化一氯.四氨.一水合钴[Ⅲ]
12.(1)[Al(OH)4] -
(2)Zn+2NaOH+2H2O=Na2Zn(OH)4+H2
(3)①③④
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成[Zn(NH3)4]2+,氨水的用量不易控制
11.(第⑷小题每空1分,其余每空2分。本题共12分)
⑴ 金刚石晶体
⑵ 金刚石、MgO、CaCl2、冰、干冰
⑶ 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;
且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)
⑷ 4 8
⑸ H2O分子之间形成氢键
14.(物质结构与性质,12分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
⑴ Mn元素价电子层的电子排布式为 ▲ ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ▲ ;
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ▲ ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ▲ ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ▲ ;
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,
在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮
等有机溶剂。据此判断三氯化铁晶体为 ▲ ;
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶胞
分别如右图所示。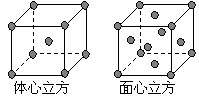 面心立方晶胞和体心立方晶胞中实际
面心立方晶胞和体心立方晶胞中实际
含有的Fe原子个数之比为 ▲ 。
14.某固体仅由一种元素组成,其密度为5.0g∕cm¯3。用X射线研究该固体的结构时得知:在边长为10¯7cm的正方体中含有20个原子,则此元素的相对原子质量是多少?
13.(4分)某配合物的化学式为 CoCl3·4NH3·H2O, 内界为正八面体构型配离子。1 mol该化合物溶于水中,加入过量 AgNO3,有2 mol AgCl生成。它的结构式是_______________,按无机化合物系统命名原则 ,命名为_________________________。
12.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为
(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com