
题目列表(包括答案和解析)
25. 酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,碘酸钾也能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下:
酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,碘酸钾也能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下:
(1)配平步骤①反应器发生的反应,并标出电子转移的方向和总数:
_____I2+______KClO3+______H2O → _____KH(IO3)2 + 5KCl + 3Cl2
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤②要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)从步骤9到步骤10得到碘酸钾晶体,操作顺序是 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
24.恒温下,将amolN2与bmolH2的混合气体通入合成塔中,发生如下反应:
N2(g)+3H2(g) 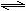 2NH3(g);25℃时,K=5×108;450℃时,K=0.152。
2NH3(g);25℃时,K=5×108;450℃时,K=0.152。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a的值为 mol;
(2)K值越大,说明正反应进行的程度越大。而工业实际生产中,没有选择25℃,却选择450℃左右的高温,其原因是_________________________________________;
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。则原混合气体中,a:b= 。
(4)若要提高该反应的化学反应速率,以下提出的方案合理的是 。
A.将高压的氢气和氮气混合气体通入合成塔中
B.将生成的氨气迅速液化分离
C.将没有转化的氢气和氮气循环利用
D.将合成塔中催化剂粉碎成更小的颗粒
23.植物生长除了需要氮、磷、钾三种元素之外,还需要硼、镁等微量元素。有一种硼镁肥料的主要成分是Mg3(BO3)2·2MgSO4·6H2O。回答下列问题:
(1)Mg3(BO3)2·2MgSO4·6H2O的氧化物形式为____________________________________,某短周期元素与硼同族,其元素原子的最外层电子排布式为__________;
(2)某短周期元素的单质和金属镁可在高温下反应,得到产物A,A与水反应生成两种碱,该元素周期表中的位置为___周期___族,写出A与水反应的化学方程式_______;
(3)比较硼和硫的非金属性强弱,硼的非金属性_______硫(填大于或小于),硼元素原子中有______种能量不同的电子;
(4)硼单质存在着多种同素异形体,某单质的熔点2300℃,沸点2550℃,原因可能是____。
A.硼单质性质与铝相似
B.硼在元素周期表中与碳相邻
C.硼单质的晶体结构为空间网状结构
D.硼元素存在着几种同位素,其中10B可用于原子反应堆
22.关于物质的检验,下列判断正确的是
A.在溶液中加入盐酸酸化,无现象;再加入BaCl2溶液,如果生成白色沉淀,则原溶液中一定有大量的SO42-存在
B.在溶液中加入AgNO3溶液,生成不溶于硝酸的沉淀,则原溶液中一定有Cl-存在
C.在溶液中加入浓NaOH溶液,加热后如果生成气体使湿润的红色石蕊试纸变蓝,则原溶液一定是铵盐溶液
D.在溶液中加入KSCN溶液,无现象;再加入稀硝酸,溶液变血红色,则原溶液中一定有Fe2+存在
第II卷(共84分)
21.下列各组物质互为同分异构体的是
A.NH4CNO和CO(NH2)2 B.CH2OHCHO和CH3COOH
C.CH3OOCCH3和CH3COOCH3 D.甘氨酸和CH3 CH2NO2
20.现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为
A.1.0g B.2.0g C.2.5g D.3.5g
19.一定量饱和Na2CO3溶液中逐滴加入稀盐酸直至过量,开始阶段无现象,后来冒气泡。以下判断错误的是
A.CO32-离子是弱酸根,开始阶段与H+结合,生成HCO3-;
B.溶液中的Na+、Cl-抑制了CO2生成;
C.开始生成的CO2与Na2CO3反应,生成了NaHCO3
D.CO32-离子在水中,存在两个水解平衡,开始阶段可能是H+结合OH-,生成HCO3-;
18.下表是元素周期表的一部分,有关说法正确的是
 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
2 |
a |
|
|
c |
|
e |
g |
|
3 |
b |
|
|
d |
|
f |
h |
A.a单质的熔点、沸点比b单质高
B.八种元素中,b元素单质的化学性质最活泼
C.八种元素的单质中,常温下有五种固体
D.c、d、f、h的最高价氧化物对应的水化物的酸性依次增强
17.将20mL2mol/LFeCl3溶液中,加入30mL6mol/L NaOH溶液充分反应后,将其蒸干并灼烧,最后得到固体的质量是
A.3.20g
B.10.22g
C.12.62g
D. 13.70g
16.右表是四种盐在不同温度下的溶解度(g/100g水):
 (假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)用物质的量之比为1∶1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如下图所示:
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)用物质的量之比为1∶1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如下图所示:
以下说法错误的是
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com