
题目列表(包括答案和解析)
10.下列说法正确的是
A.使品红溶液褪色的气体一定是SO2
B.观察焰色反应实验为黄色火焰,则该溶液只有Na+
C.滴入用HCl酸化的BaCl2溶液有白色沉淀的溶液一定含SO42-
D.滴入KSCN溶液无现象、滴入氯水变为红色的溶液一定含Fe2+
9.已知:(1)H2O(g)===H2O(l) ΔH=-Q1 kJ/mol
(2)CH3OH(g)===CH3OH(l) ΔH2=-Q2 kJ/mol
(3)2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(g) ΔH3=-Q3 kJ/mol
Q1、Q2、Q3均大于0。若要使32 g液态甲醇完全燃烧并恢复到室温,放出的热量为
A.Q1+Q2+Q3 C.5Q3+Q2-2Q1 C.0.5Q3-Q2+2Q1 D.0.5(Q1+Q2+Q3)
C.5Q3+Q2-2Q1 C.0.5Q3-Q2+2Q1 D.0.5(Q1+Q2+Q3)
8.下列反应的离子方程式正确的是
A.氯化铁溶液腐蚀铜:Fe3++Cu=Cu2++Fe2+
B.烧碱溶液腐蚀毛玻璃:SiO2+2OH- SiO32-+H2O
C.钠与水反应:Na + H2O=Na+ + H2↑ + OH-
D.氯气溶于水:Cl2 + H2O = 2H+ + Cl-+ ClO-
7.下面对日本福岛核电站泄漏的放射性碘-131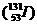 、铯-137
、铯-137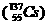 说法正确的是
说法正确的是
A.碘-131的中子数为78 B.碘-131质量数为53
C.碘与铯互称同位素 D.铯-137的放射性是化学性质
31.绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O。回答下列问题:
(1)绿矾受热分解后,铁元素的化合价在分解前后是否发生了变化______(填“是”或“否”),其理由是__________________________________________________。
(2)在FeO、Fe2O3、Fe3O4三种化合物中,与等质量Fe元素相结合的氧元素的质量比是___________________________________。
 (3)将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度是多少?
(3)将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度是多少?
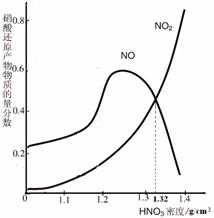
(4)由图示可知,m mol铁与过量的硝酸(ρ=1.32 g/cm3)反应,反应放出n L气体(体积在标准状况下测定),其还原产物主要是 ;此时溶液中Fe元素的存在形式是 ,n 的值是多少?
2011年松江区高考模拟考试
30. NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O→ Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如右图。(已知盐酸滴加至10mL时,开始产生气体,加至15mL时生成CO2112mL,溶解的CO2忽然不计)
NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O→ Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如右图。(已知盐酸滴加至10mL时,开始产生气体,加至15mL时生成CO2112mL,溶解的CO2忽然不计)
试求:(1)所加盐酸物质的量浓度
(2)x的值
(3)样品A中的成分及各成分的物质的量。
29. 有机物A、B、C、D、E、F、G、H相互关系如下图。5.9克H能与100mL1mol/LNaOH溶液恰好完全反应。0.1molH还能与足量的钠反应放出2.24L(STP)氢气,H分子结构中含有一个甲基。
有机物A、B、C、D、E、F、G、H相互关系如下图。5.9克H能与100mL1mol/LNaOH溶液恰好完全反应。0.1molH还能与足量的钠反应放出2.24L(STP)氢气,H分子结构中含有一个甲基。
(1)写出H的结构简式:____________;E的结构简式:______________________;
(2)C→G的反应类型是_________、D→E的反应类型是___________;
(3)写出 D→E 的化学反应方程式______________________________;
(4)写出 A →E + F的化学反应方程式______________________;
(5)A、B、C、D、E、F、G、H中属于同一种物质的是__________;
(6)H的同分异构体有很多种,写出两种属于二元酯类的同分异构体_____________。
28.有分子式为C4H10O2的一种同分异构体A 有如下转化关系。

填写下列空白:
(1)A 的结构简式为_________________;B 中的官能团名称是___________________;
(2)D 的化学式为_______________________;
(3)写出 B 与银氨溶液反应的化学方程式:___________________________________;
(4)写出C→D的化学方程式__________________________________。
27. 氯化亚铜在有机合成工业中常作催化剂。以下是从含Cu2+、Fe3+的电镀废水中制备氯化亚铜的工艺流程图。
氯化亚铜在有机合成工业中常作催化剂。以下是从含Cu2+、Fe3+的电镀废水中制备氯化亚铜的工艺流程图。
 下图是滤液中Cu2+、Fe3+的含量与pH的关系及CuCl产率与pH的关系图。
下图是滤液中Cu2+、Fe3+的含量与pH的关系及CuCl产率与pH的关系图。
请回答以下问题:
(1)在电镀废水中加碱产生沉淀,过滤得到电镀污泥,则电镀污泥的主要成分为____;
(2)由反应①制备CuCl时的最佳pH在__________左右;
(3)对CuCl产率探究时发现反应①在隔绝空气条件下进行时CuCl产率较高,由此推测CuCl具有__________性;
(4)写出反应①中化学反应方程式:_____________________________;
(5)隔绝空气条件下,从滤液中制得晶体的实验操作为:___________;
(6)取晶体4.34g隔绝空气条件下,失去结晶水后得固体3.26g,所得固体溶于水分成二等份,一份加入足量BaCl2溶液,得到白色固体2.33g;另一份加入足量NaOH溶液后,加热、灼烧得红色粉末0.4g。写出晶体的化学式:_____________。
26.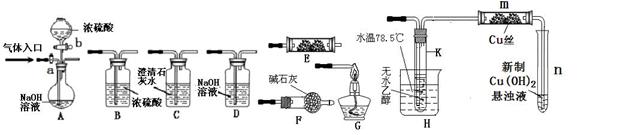 下图为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去,已知乙醇的沸点为78.5℃),请根据要求完成下列问题(仪器装置可任意选用,必要时可重复选择,a、b为旋钮)。
下图为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去,已知乙醇的沸点为78.5℃),请根据要求完成下列问题(仪器装置可任意选用,必要时可重复选择,a、b为旋钮)。
(1)将A中a旋钮打开,通入CO和CO2的混合气体,欲得到纯净干燥的CO,装置的连接顺序为:A接_______(填写装置代号);若要验证CO的还原性及氧化产物,E内应放置______,装置的连接顺序为:A→C→B→E→C→G,能验证CO氧化产物的实验现象是___________。
(2)完成(1)实验后,将A中a旋钮关闭,并在E内换成放置Na2O2,按A→E→D→B→H装置顺序,制取纯净干燥的O2,并用O2氧化乙醇。
① 为获得氧气,关闭a旋钮后,首先需进行的操作是 。
② 将试管K放入水温78.5℃或略高于78.5℃的水浴中加热的目的是 。
m中发生反应的化学方程式是____________________
③ 若想观察到试管n中有红色沉淀出现,还需要进行的操作是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com