
题目列表(包括答案和解析)
6、(2011东城26.(11分)一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是 。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③ 。甲同学为探究溶液的组成,实验如下:
|
实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
|
取少量溶液A于试管中, 加入KSCN溶液。 |
|
假设②不成立,假设①或③成立; 反应的离子方程式是 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论: (填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
根据你选择的实验结论,简述理由: 。
答案:26. (11分)(1)(2分)2Fe+3Cl2 2FeCl3 (2)③(2分)含有Fe3+ 和Fe2+
(4分)
|
实验现象 |
实验结论及反应离子方程式 |
|
溶液呈红色 |
Fe3++3SCN-=Fe(SCN)3 |
(3)(3分)a;因为还原性Fe2+>Cl-,逐滴加入的酸性KMnO4溶液,先将Fe2+氧化,而使KMnO4紫色褪去,故可能含有Fe2+。
b;溶液中可能无Fe2+,加入的酸性KMnO4溶液,将Cl-氧化,而使KMnO4紫色褪去。
5、(2011东城27)16分)
 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
①CS2+3Cl2 CCl4+S2Cl2 ;②2S+ Cl2 S2Cl2 。
已知:S2Cl2易与水反应;下表是几种物质的熔沸点:
|
物质 |
S |
CS2 |
CCl4 |
S2Cl2 |
|
沸点/℃ |
445 |
47 |
77 |
137 |
|
熔点/℃ |
113 |
-109 |
-23 |
-77 |
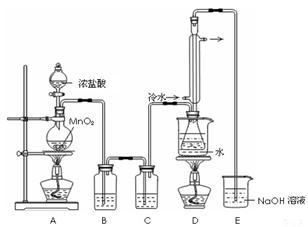
(1)利用图-21装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是 (填写数字序号)。
(2)A中反应的离子方程式是 ;C中存放的试剂是 。
(3)D装置中冷凝管的作用是 ;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是 。
(4)S2Cl2分子中各原子最外层均满足8电子稳定结构,该分子的电子式是 。
(5)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化学方程式是 。
答案 27.(16分,方程式3分,其余每空2分)(1)①
27.(16分,方程式3分,其余每空2分)(1)①
(2)MnO2+4H++2Cl- Mn2++Cl2↑+ 2H2O ;浓硫酸
(3)冷凝回流(导气) 蒸馏
(4)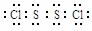
(5)2S2Cl2+ 2H2O=3S↓+SO2↑+4HCl↑
4、(211西城一模27.)(14分)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。

(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。

① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要
(填“是”或“否”) 。
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号) 。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)
+4Cl-(aq)  CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 黄色
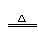
① 上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) 。
② 取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号) 。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
答案:(14分)
 (1)①(2分)分液漏斗
(1)①(2分)分液漏斗
②(2分)MnO2 +4H++2Cl- Mn2++ Cl2↑+2H2O
③(2分)否
(2)(2分)c d
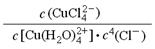 (3)①(2分)
(2分)不变
(3)①(2分)
(2分)不变
②(2分)abc
3、(211西城一模9.)向如下图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。X和Y可能是
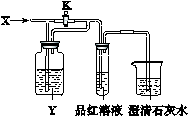
|
|
A |
B |
C |
D |
|
X |
SO2 |
NO2 |
HCl |
Cl2 |
|
Y |
饱和NaHCO3溶液 |
水 |
Na2SO3溶液 |
Na2SO3溶液 |
2、(211海淀一模28.)(14分)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
[实验1]铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为 。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
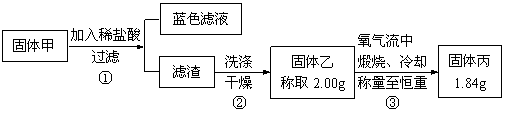 为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图21的实验:
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图21的实验:
图21
(4)②中检验滤渣是否洗涤干净的实验方法是 。
(5)③中在煅烧过程中一定发生的反应的化学方程式为 。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项) 。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
答案:28.(14分)
(1)2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
………………………(3分)
CuSO4+SO2↑+2H2O
………………………(3分)
(2)试管A中气体压强减小,空气从D导管进入试管A中……………………(2分)
(3)从D管口向A中大量鼓气 ……………………(2分)
(4)取最后一次洗涤后所得液体于试管中,滴加硝酸银溶液,若无白色沉淀产生,则说
明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净…………………(2分)
(5)2CuS+3O2 2CuO+2SO2 (条件也可为“煅烧”) …………………(3分)
2CuO+2SO2 (条件也可为“煅烧”) …………………(3分)
(6)BCD(选对两个选项得1分,只选对一个选项不得分,多答、错答不得分)(2分)
1、(2011朝阳区27.)(14分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
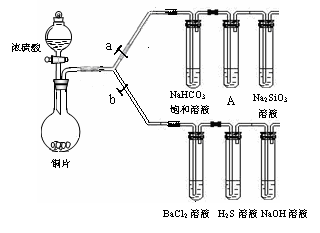
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是 。
装置A中试剂是 。
③ 能说明碳的非金属性比硅强的实验现象是 。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。
② H2S溶液中有浅黄色浑浊出现,化学方程式是 。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
|
滴加的溶液 |
氯水 |
氨水 |
|
沉淀的化学式 |
|
|
写出其中SO2显示还原性生成沉淀的离子方程式 。
答案1.(14分)
(1)① 检验装置气密性
② Cu + 2H2SO4(浓) △ CuSO4 + SO2↑+ 2H2O
KMnO4溶液
③A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)2H2S + SO2 = 3S↓ + 2H2O
|
|
|
|
|
|
BaSO4 |
BaSO3 |
Ba2+ + SO2 + Cl2 + 2H2O == BaSO4↓+ 4H+ + 2Cl-
14.(2011延庆25.)(15分)分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
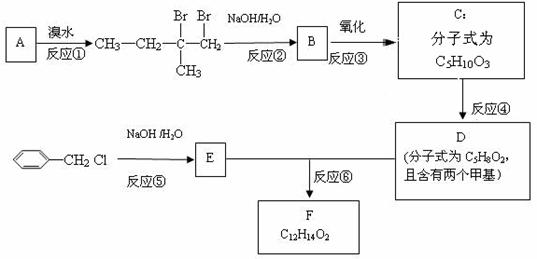
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;峰面积比为
(2)C物质的官能团名称
(3)上述合成路线中属于取代反应的是 (填编号);
(4)写出反应④、⑤、⑥的化学方程式:④ ⑤ ⑥
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;
答案(15分)
(1)(2分) 4 3:2:3:2(没有顺序)
(2)(2分,答对1个得1分) 羟基、羧基;
(3)(2分,漏1个扣1分,错1个扣)②⑤⑥
(4)(6分) ④
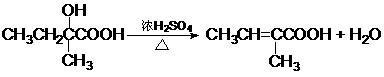
⑤
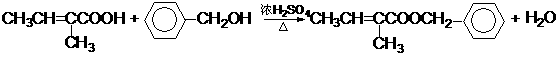 ⑥
⑥
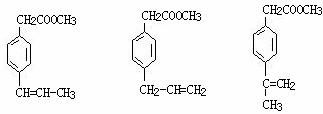 (5) (3分,答对1个1分)
(5) (3分,答对1个1分)
13、(2011延庆12.)夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。 “魔棒”发光原理是利用过氧化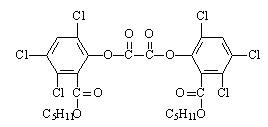 氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如右图。下列说法正确的是:
氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如右图。下列说法正确的是:
A.草酸二酯的分子式为C26H22Cl6O8
B.1mol草酸二酯与氢氧化钠稀溶液反应时
(苯环上卤素不水解),最多消耗6molNaOH
C.草酸二酯水解可以得到两种有机物
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
12、(2011海淀9.)扑热息痛是一种优良的解热镇痛药,结构式为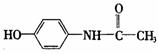 下列说法中不正确的是
下列说法中不正确的是
A.扑热息痛的分子式为C8H9NO2
B.扑热息痛可与烧碱溶液、浓溴水溶液发生反应
C.扑热息痛很稳定,不容易被氧化
D.扑热息痛核磁共振氢谱上有5个峰,峰面积之比为1:1:2:2:3
11、(2011海淀0模27.)(16分)有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰。
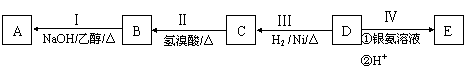
请回答:
(1)D的分子式为 ;
(2)B中所含官能团的名称为 ;
(3)Ⅲ的反应类型为 (填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)写出下列反应的化学方程式:
Ⅰ: ;
Ⅱ: ;
C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为 ;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,它们的结构简式为 和 ;
(6)E有多种同分异构体,其中含有
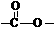 结构的有 种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
结构的有 种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
答案.(16分)
(1)C5H10O (答案合理给分) ……………………………………………………1分
(2)溴原子 …………………………………………………………………………1分
(3)a、b …………………………………………………………………………2分
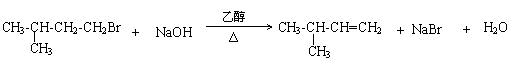 (4)
(4)
I:
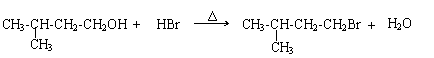 …………2分
…………2分
II:
…………2分

…………2分
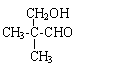 (5)
(5)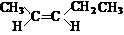
 …………各1分
…………各1分
(6)12 (答案合理给分) …………………各2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com