
题目列表(包括答案和解析)
(一)必考题(共11道题,129分)
26.(14分)Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用右图装置使用Fe,H2SO4(稀),NaOH溶液可在还
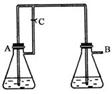 原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其
原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其
中C为弹簧夹。(提示:还原性气氛如氢气环境)
(1)则锥形瓶A中应加入的药品为_________________.(2分)
(2)锥形瓶B中应加入的药品为__________________.(2分)
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2
的后续操作步骤。
①_____________________ ②_______________________________。(4分)
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:
;(2分)
请写出此时B瓶中发生的化学反应的离子方程式:
;(4分)
27. (15分)下列图中A-F是中学化学常见化合物,且A﹑B﹑E﹑F均含有相同一种金属元素,G是一种常见单质。
(15分)下列图中A-F是中学化学常见化合物,且A﹑B﹑E﹑F均含有相同一种金属元素,G是一种常见单质。
①A(固体) B + C + D ②C + E → B + G; ③ D + E → F + G
④A(溶液)+F(溶液)→B(溶液)+D ⑤B(溶液) + C + D → A(溶液)
(1)写出A﹑B﹑C﹑E﹑F的化学式:A__________ B_________ C__________
E__________ F__________(5分)
(2)写出反应①②④⑤的化学方程式:
①_________________________________________________(2分)
②_________________________________________________(2分)
④_________________________________________________(2分)
⑤_________________________________________________(2分)
(3)请写出化合物E的两种重要用途:____________________________(2分)
28.(14分)(1)现有浓度各为1 mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:
①充分反应后铁粉有剩余,则溶液中一定含有__________阳离子,一定没有__________阳离子。(2分)有关反应的离子方程式是__________________________
__________________________________________________________。(2分)
②充分反应后铁粉无剩余,有铜生成。则反应后的溶液中一定含有_________阳离子;溶液中可能含有_________阳离子,该阳离子在溶液中物质的量的可能存在范围是: ______________________。(4分)
③充分反应后,无固体沉淀物存在,反应后的溶液中一定含有____和____阳离子。(2分)
(2)现有AlCl3和FeCl3的混合溶液,其中Al3+ 和Fe3+ 的物质的量之和为0.1 mol。在此溶液中加入90 mL 4 mol / L的NaOH溶液,使其充分反应;设Al3+ 的物质的量与总物质的量的比值为x。
①根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是___________;物质的量是__________mol。(2分)
②计算沉淀中只有Fe(OH)3时的x的取值范围:_____________________。 (2分)
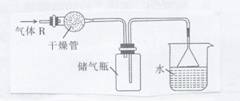 7.实验室里可按如图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
7.实验室里可按如图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
A.HCl B.Cl2 C.CO D.NH3
8.下列实验装置图完全正确的是( )

A.称量氢氧化钠固体 B.配制150mL0.10mol•L-1盐酸
C.测定中和热 D.分离苯和甲苯
9.NaCl固体中混有下列杂质时,可以利用加热的方法进行提纯的是( )
A.KClO3 B. K2SO4 C. NH4Cl D. NaHCO3
10.14C是碳的一种同位素,NA为阿伏加德罗常数,下列说法不正确的是( )
A.1mol14CH4分子中所含中子数为8NA
B.7g14C原子形成的石墨中所含质子数为3NA
C.17g甲基(-14CH3)所含电子数为8NA
D.标准状况下22.4L14CO2的分子数为NA
11.50g浓度为c mol•L-1,密度为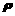 g•cm-3的氨水中加入一定量的水稀释成0.5cmol•L-1,则加入水的体积为( )
g•cm-3的氨水中加入一定量的水稀释成0.5cmol•L-1,则加入水的体积为( )
A.小于50ml B.等于50ml C.大于50ml D.等于50/pml
12.下列实验可以获得预期效果的是( )
A.用金属钠检验乙醇中是否含有少量水
B.用稀氨水洗涤银镜反应实验后粘有银的试管
C.用点燃的方法鉴别乙烯和乙炔
D.用湿润的pH试纸测定溶液的pH
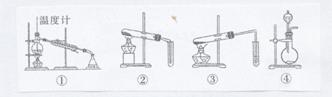 13.以下均为中学化学实验中的常见实验装置,下列有关说法正确的是( )
13.以下均为中学化学实验中的常见实验装置,下列有关说法正确的是( )
A.装置①,可用于分离沸点不同的两种液态有机物
B.装置②,可用于检验碳酸钠与碳酸氢钠两种固体
C.装置③,可用于实验室制取少量乙炔
D.装置④,选择合适药品时,可用于制取少量氨气或乙烯等
第Ⅱ卷(必考题129分,选考题45分,共174分)
本卷包括秘考题和选考题两部分。第22-32题为必考题,每个试题考生都做答;第33题-41题为选考题,考生根据要求作答。
(二)选考题(共45分。请从给出的2道物理题、2道化学题、2道生物题中每科任选一题做答。)
35.[化学--选修物质结构与性质](15分)
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________________;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由________________________________________________________________________。
36.[化学--有机化学基础](15分)
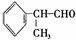 氢化阿托醛
是一种重要的化工原料,其合成路线如下:
氢化阿托醛
是一种重要的化工原料,其合成路线如下:
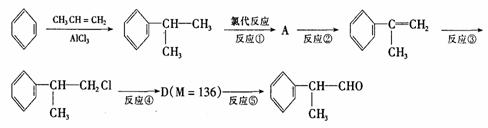
(1)氢化阿托醛被氧化后的含氧官能团的名称是 。
(2)在合成路线上②③的反应类型分别为② ③ 。
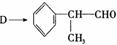
(3)由 反应的化学方程式为 。
(4)1mol氢化阿托醛最多可和______mol氢气加成,1mol氢化阿托醛发生银镜反应可生成__________molAg。
(5)D与有机物X在一定条件下可生成一种相对分子质量为178的酯类物质,则X的结构简式为 。D有多种同分异构体,能满足苯环上有两个取代基,且能使FeCl3溶液显紫色的同分异构体有 种。
(一) 必考题(11题,共129分)
26.(14分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +
H2O(g) ΔH2
CH3OH(g) +
H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
 ② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0
kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0
kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
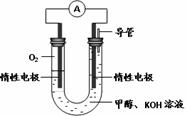
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
27.(14分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。
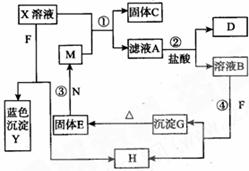
请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(3分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。
28.(15分)Ⅰ 下图所示A-- H为实验室常见的仪器、装置(部分固定夹持装置略去),请根据要求回答下列问题。
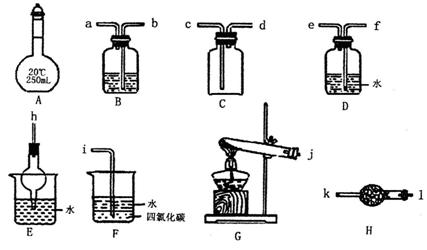
(1)A仪器的名称是________________________。
(2)用图示仪器设计一套制取纯净、干燥的氨气的装置,仪器的连接顺序是(用管口字母符号表示)j--___、--_____、--____、--___、--____、--____(可不填满)。
Ⅱ 某校化学兴趣小组为研究Cl2单质的性质,设计如下图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
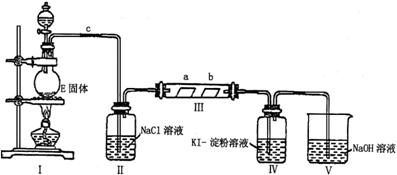
(3)Ⅰ的反应方程式为:________________________
(4)加入药品前,检查I中气体发生装置气密性的操作是:_________________。
(5)实验过程中,装置IV中的实验现象为_______________________________________;
(6)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在_________之间还需添加洗气瓶(选填装置序号),该装置的作用是______________________。
13.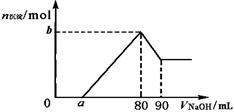 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图所示。下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图所示。下列说法中错误的是( )
A.HCl溶液的体积为80mL
B.a的取值范围为0≤a<50
C.当a值为30时,b值为0.01
D.当a值为10时,b值为0.03
第Ⅱ卷(非选择题,共174分)
12.X、Y、Z为短周期元素,原子序数依次增大.X的最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X和Z在同一主族.下列叙述不正确的是 ( )
A.原子半径:Y>Z
B.Z的单质在氧气中点燃可生成两种酸性氧化物
C.Y的氧化物是工业制取Y单质的主要原料
D.X元素的一种单质可用于消毒杀菌
11.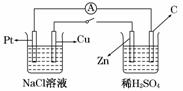 如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是
( )
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是
( )
A.Cu极为原电池负极
B.Cu极附近OH-浓度增大
C.电子流向是由C极流向Pt极
D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成
10.下列叙述正确的是 ( )
A. 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH= b,则a>b
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH< 7
C. 常温下,1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸pH=8.0
D. 若1mL pH=1盐酸与100mL NaOH溶液混合后,溶液PH=7,则NaOH溶液的pH=11
9. 下列关于有机物的说法中,正确的一组是 ( )
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
④石油的分馏、裂化和煤的干馏都是化学变化
⑤淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
⑥塑料、橡胶和纤维都是合成高分子材料
A.①③⑤ B.②④⑥
C.①②⑤ D.③④⑥
8. 关于下列各实验装置的叙述中,不正确的是 ( )
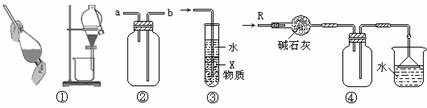
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com