
题目列表(包括答案和解析)
25.(1)m=20.0,n=20.0(各1分,共2分)
(2)4.5×10-4‑mol/L·min(3分)
(3)①1.4min (2分) ②1,1(各1分,共2分)
(4)①降低 (2分)
②2Fe3++2I-=2Fe2++I2 2Fe2++H2O2+2H+=2Fe3++2H2O(各2分,共4分)
(5)水浴加热(或其他合理答案如:过氧化氢不加热只加热其他试剂)(2分)
24.(1)偏小(2分)
(2)12 (3分)
(3)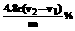 (3分)
(3分)
(4)①6-7-4-5-3或6-7-5-4-3(2分)
②不一定准确。(2分)
如果蛋壳中钙元素全部以碳酸钙形式存在,且不再含有能与盐酸反应产生酸性气体的其他物质,则测定结果准确;否则不准确。(开放性试题,只要合理均酌情给分)(2分)
23、(1)不需要
(2)Al2O3+2NaOH=2NaAlO2+H2O
SiO2+2NaOH=Na2SiO3+H2O(各2分,共4分)
(3)TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti)(2分)
(4)碳单质会与阳极产生的氧气反应而不断减少(2分)
(5)-243Kj ·mol-1(3分)
(6)碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行(2分)
31. [化学--有机化学基础](13分)
[化学--有机化学基础](13分)
 格氏试剂(RMgX)是有机反应中的一种重要试剂,它的制法为:Rx+Mg RMgX(R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为:
格氏试剂(RMgX)是有机反应中的一种重要试剂,它的制法为:Rx+Mg RMgX(R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为:
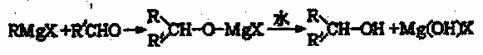
(R,R,可以是相同的烃基,也可能是不伺的烃基)现用乙烯和适当的无机物合成乙酸异丁酯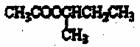 的过程如下(反应条件没有列出):
的过程如下(反应条件没有列出):
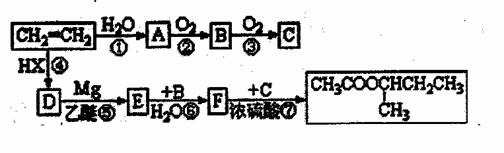
试回答:(1)上述过程中,属于加成反应的是 (填反应序号),并写出下列指定物质的结构筒式:C E F 。
(2)反应②的化学方程式 ;
(3)反应③的化学方程式 ;
石狮一中2011届高三第三次理科综合能力测试答案
化学部分
30.[化学--物质结构与性质(13分)
现有部分前四周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
第三周期中的半导体材科 |
|
B |
L层s电子数比p电子数少l |
|
C |
地壳中含量最高的元素 |
|
D |
第三周期主族元素中其第一电离能最大 |
|
E |
第四周期中未成对电子数最多 |
( 1)写出元素E基态原子的电子排布式: 。
(2)B单质分子中,含有
个 键和
个
键和
个 键,元素B的气态氢化的空间构型为
。
键,元素B的气态氢化的空间构型为
。
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)C单质的熔点 A单质的熔点(填“高于”或“低于”),其原因是:
。
25.(17分)已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
溶液开始变蓝时间(min) |
||||
|
0.1 mol·L-1 KI溶液 |
H2O |
0.01 mol·L-1 X 溶液 |
0.1 mol·L-1 双氧水 |
1 mol·L-1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
0 |
10.0 |
10.0 |
40.0 |
无 |
t |
|
5 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m= ,n=
(2)已知,I2与X反应时,两者物质的量之比为1:2。实验3从开始至反应进行到2.8min时,此段时间内H2O2+2H++2I-→2H2O+I2反应速率v(I-)=_________________。
(3)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=___________。
②根据上表数据可知,a、b的值依次为 和 。
(4)实验5表明:硫酸铁能提高反应速率。
①催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程。
、 (不必配平)
(5)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致双氧水大量分解,应该采取的加热方式是 。
选考部分
第II卷选考部分共5小题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
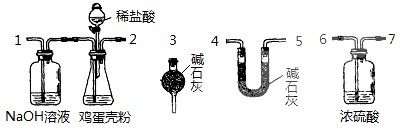
24.(13分)鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。

(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将 (填“偏大”、“偏小”或“无影响”);
(2)测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于 (已知:ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行)。
 (3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是
。
(3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是
。
(4)有同学提出可采用如上装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量。
①采用该方法进行实验,各装置从左到右的连接顺序依次1-2-__________________(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
答:________(填“准确”、“不准确”或“无法判断”)。原因是_____________________。
23.(15分)TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。答: 。
II、TiO2可通过下述两种方法制备金属钛:
方法一是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s) +2Cl2 (g)  TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s) + O2 (g) = CO2 (g) △H = - 394 kJ·mol-1。请填空:
TiO2 (s) + C (s) +2Cl2 (g) = TiCl4 (l) + CO2 (g) △H = ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________________________。
13.物理学的发展丰富了人类对物质世界的认识,推动了科学技术的创新和革命,促进了物质生产的繁荣与人类文明的进步。下列关于科学家对物理学发展做出的巨大贡献表述正确的是( )
A.伽利略最先提出了万有引力定律 B.麦克斯韦预言了电磁波的存在
C.安培发现了电磁感应定律 D.汤姆孙建立了原子核式结构理论
第Ⅱ卷 必考部分
12.室温下,下列叙述正确的是( )
A.0.1 mol·L-1醋酸钠溶液中:c(Na+)=c(CH3COO-)
B.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7
C.0.1 mol·L-1与0.2 mol·L-1醋酸溶液中醋酸电离平衡常数之比为1︰2
D.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com