
题目列表(包括答案和解析)
4、用碳粉还原氧化铜的实验,加热一段时间后,发现装入澄清石灰水的试管出现浑浊,继续加热,但始终没有看到黑色固体变红的现象。实验失败的饿原因可能是 ( )
A.碳过量很多 B.氧化铜过量很多 C.反应还没有发生 D.装置漏气
3、在一密闭容器的真空容器内高温加热氧化铜和碳的混合物,充分反应后,容器内的物质为金属单质和一种纯净的气体,则混合物中氧化铜和碳的质量比可能是 ( )
A.40∶3 B.1∶1 C.2∶1 D.20∶3
2、在如图所示的密闭容器中有一个理想活塞(滑动自如,且密封性绝对可靠),处在容器体积的1/4处;其中,1/4的部分充的是空气,另3/4的部分充的是H2和O2的混合气体;当后者用电火花点燃引爆时,活塞先被冲到左边;而当容器内的气体逐渐恢复到原来的温度时,活塞渐渐向右边移动,最终停在容器容积的1/2处,则原来的氢气和氧气的体积比可能是( )
A.8∶1
B.7∶2 
C.4∶5 D.2∶7
1、锌与硫酸反应生成氢气,几次锌的用量不同,但硫酸用量相同,x轴表示锌的用量,y轴表示生成气体体积。同温同压下实验结果如图所示。下列对实验结果描述正确的是 ( )
A.线段OA(包括A点)表示锌与过量硫酸反应 
B.线段OA(不包括A点)表示锌与过量硫酸反应
C.线段AB(包括A点)表示锌过量
D.线段AB(不包括A点)表示锌过量
8]+[(n-1)×12]+[n×12]+[(n-1)2×6]+[n2x6]+[(n-1)×n×2×6]
顶角 棱上棱交点 棱上棱心 面上棱交点 面上面心 面上棱心
n=10,表面原子总数为2402 (2分)
步骤二:计算晶胞聚合体总原子数:
n3×8+[8] ×7/8+[(n-1)×12]×3/4+[n×12]×3/4+[(n-1)2×6]/2+[n2×6]/2+[(n-1)×n×2×6]/2
=8000+7 + 81 + 90 + 243 + 300 + 540
=9261 (2分)
表面原子占总原子数的百分数: (2402/9261)×100%=26% (1分) (总5分)
(注:本题计算较复杂,若应试者用其他方法估算得出的数值在26% 左右2个百分点以内可得3分,3个百分点以内可得2分,其估算公式可不同于标准答案,但其运算应无误。本题要求作估算,故标准答案仅取整数,取更多位数不扣分。)
(02)第5题(13分)六配位(八面体)单核配合物MA2(NO2)2呈电中性;组成分析结果:M 21.68%, N 31.04%, C 17.74%;配体A含氮不含氧;配体 (NO2)x 的两个氮氧键不等长。
5-1。该配合物中心原子M是什么元素?氧化态多大?给出推论过程。
5-2。画出该配合物的结构示意图,给出推理过程。
5-3。指出配体 (NO2)x在“自由”状态下的几何构型和氮原子的杂化轨道。
5-4。除本例外,上述无机配体还可能以什么方式和中心原子配位?用图形回答问题。
 5-1。 nM : nN
= 21.68/MM : 31.04/14 = 1 :(2y
+ 2)
5-1。 nM : nN
= 21.68/MM : 31.04/14 = 1 :(2y
+ 2)
MA = 19.56x(y+1)
y=2(设y为其他自然数均不合题意),得 MM = 58.7 (g/mol)
查周期表,M = Ni
由配体 (NO2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O,
故配体为NO2-,因此,Ni的氧化数为+2。(4分)
(推理过程合理都给分,不合理, 即使结果正确也扣2分。)
5-2。 设配合物中碳原子数为nC,则:nC : nN = 17.74/12 : 31.04/14 = 0.667
已知 nN = 2x2+2 = 6, 所以,nC = 0.677x6 = 4
求出摩尔质量,由于剩余量过小,只能设A是氮氢化合物,由此得氢数,可
推得配体A为H2NCH2CH2NH2,
配合物的结构示意图为:

 (4分)(合理推理过程2分,结构图2分)
(4分)(合理推理过程2分,结构图2分)
5-3。 (根据VSEPR理论,可预言)NO2-为角型,夹角略小于120o, N取sp2杂化轨道。
(2分)
5-4。(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也
应得分,如氧桥结构、NO2-桥结构等) (3分)
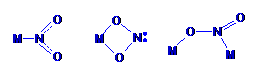
5. 最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。
最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。
[答案]
Ti14C13(2分)
说明:凡按晶胞计算原子者得零分。
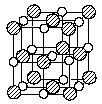
(01)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
5-1 由图5-1可确定硼化镁的化学式为: 。
5-2 在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。

图5-1硼化镁的晶体结构示意图
答案:第5题(5分)5-1 MgB2 (2分)(注:给出最简式才得分)
 或
或
 a = b ≠ c,c轴向上(3分)
a = b ≠ c,c轴向上(3分)
5-2 (注:任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。)
(01)第11题(10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则:
11-1 第二层离子有 个,离中心离子的距离为 d,它们是 离子。
11-2 已知在晶体中Na+离子的半径为116pm,Cl-离子的半径为167pm,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。
11-3 纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
11-4 假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞边长的10倍,试估算表面原子占总原子数的百分比。
答案:第11题(10分)12,  ,钠 (各1分,总3分)
,钠 (各1分,总3分)
11-2 晶胞体积V=[2×(116pm+167pm)]3=181×106pm3
离子体积 v=4x (4/3)π(116pm)3+4x (4/3)π(167pm)3=104×106 pm3
v/V=57.5% (1分)(有效数字错误扣1分,V和v的计算结果可取4位,其中最后1位为保留数字,不扣分。)
11-3表面原子为8(顶角)+6(面心) +12(棱中心)=26
总原子数为 8(顶角)+6(面心)+12(棱中心)+1(体心)=27
表面原子占总原子数 26/27×100%=96 %(1分)
 注:26和27均为整数值,比值26/27是循环小数0.962, 取多少位小数需根据实际应用而定, 本题未明确应用场合,无论应试者给出多少位数字都应按正确结果论。
注:26和27均为整数值,比值26/27是循环小数0.962, 取多少位小数需根据实际应用而定, 本题未明确应用场合,无论应试者给出多少位数字都应按正确结果论。
11-4 计算分两个步骤:
步骤一:计算表面原子数。可用n=2、3的晶胞聚合体建立模型,得出计算公式,用以计算n=10。例如,计算公式为:
5.一辆客车夜晚行驶在公路上,发现油箱泄漏,车厢里充满了汽油的气味,这时应该采取的应急措施是( )
A.洒水降温溶解汽油蒸气 B.开灯查找漏油部位
C.让车内的人集中到车厢后部 D.打开所有车窗,严禁一切烟火,疏散乘客
[答案]1.AD 2.C 3.C 4.BC 5.D
4.国外试行用“汽水”(碳酸饮料)浇灌植物,它的作用是( )
A.对植物的呼吸作用有利 B.改良碱性土壤,调节土壤的pH
C.加速光合作用的进行 D.在植物上方形成温室
3.下列物质肯定为纯净物的是( )
A.由同种元素组成的物质 B.由不同种元素组成的物质
C.由同种分子构成的物质 D.由一种元素的阳离子跟另一种元素的阴离子构成的物质
2.粗食盐中常含CaCl2、MgCl2、Na2SO4杂质,需加入NaOH溶液、Na2CO3溶液、BaCl2溶液和盐酸(均过量),然后过滤、蒸发,可制得精盐,所加四种溶液的顺序不正确的是( )
A.NaOH、BaCl2、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.Na2CO3、BaCl2、NaOH、HCl D.BaCl2、NaOH、Na2CO3、HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com