
题目列表(包括答案和解析)
21(8分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液 干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、_____________等玻璃仪器。
(2)步骤1过滤的目的是_____________________________
(3)步骤2中的溶液pH=8-9时,检验沉淀是否完全的方法是
(4)步骤2中溶液的pH控制较难操作,可改用___________________
(5)将步骤4补充完整
22.(11分)某化学研究性小组要通过实验来证明一种液体(分子式C2H6O)分子的结构。
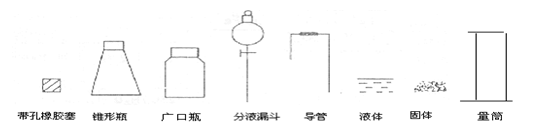 (1)下列简图,画出证明分子结构的实验装置(含试剂)示意图。
(1)下列简图,画出证明分子结构的实验装置(含试剂)示意图。
(2) 实验过程中,使用分液漏斗滴加液体的操作是______________。
(3)实验时测得加入的C2H6O为0.46g,则量筒中最后收集到的水为 mL(假设为标准状况)时,C2H6O的结构简式是C2H5OH。
理由是
(4)若加入的液体是乙醇,测出的H2体积偏小的可能原因是 当乙醇中混有水时,测出的H2体积偏 (填大、小)。
(5)若C2H6O的红外光谱图如下:
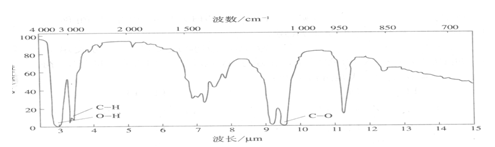
则它的结构简式是
20.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A 可用铁作阳极材料
B 电解过程中阳极附近溶液的pH升高
C 阳极反应方程式为:2Cl--2e-=Cl2
D 1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
19. 单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:
① FeTiO3 +2H2SO4=TiOSO4+ FeSO4 +2H2O
② TiOSO4 +2H2O=H2TiO3↓+H2SO4
③ H2TiO3 TiO2+H2O
TiO2+H2O
④ TiO2 +2C +2Cl2 TiCl4+2CO
TiCl4+2CO
⑤ TiCl4 +2Mg=2MgCl2 +Ti
下列叙述不正确的是
A. 反应①不是氧化还原反应
B. 反应②是水解反应
C. 反应④中TiO2是氧化剂
D. 反应⑤表现了金属镁还原性比金属钛强
18.下述实验不能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入溴水中 |
证明SO2具有漂白性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 |
研究温度对化学平衡的影响 |
|
D |
20℃和50℃分别向两试管中加入同体积同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
17. 对可逆反应2SO2(g)
+ O2(g) 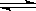 2SO3(g),下列判断正确的是
2SO3(g),下列判断正确的是
A. 若单位时间内生成x molSO3的同时,消耗x mol SO2,则反应达到平衡状态
B.
达到化学平衡时,2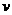 正(O2)=
正(O2)=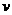 逆(SO3)
逆(SO3)
C. 平衡时,SO2的浓度必定等于O2浓度的2倍
D. 达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
16. 常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是
A. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
15、现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 |
1.02 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高化合价 最低化合价 |
+6 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
下列说法正确的是:
A.⑦号元素的氢化物溶于水显碱性
B.②号的氧化物是离子化合物
C.①号元素的氢化物的水溶液在空气中存放不易变质
D.④号和⑤号元素最高价氧化物对应的水化物都是强酸
14、下列各组离子在溶液中可以大量共存,且加入过量氨水也不产生沉淀的是
A、K+ Ba2+ NO3- SO42- B、H+ NH4+ Al3+ SO42-
C、Na+ AlO2- Cl- OH- D、H+ Cl- CH3COO- NO3-
13.下列有关实验问题叙述正确的是
A.测定中和热时,用环形玻璃搅拌棒搅拌溶液使测得的温度更准确
B.利用烧杯、玻璃棒、量筒、容量瓶就可以配制2mol/L的硫酸溶液
C.用pH计测得某次雨水的pH为3.7
D.用标准浓度HCl滴定未知浓度NaOH溶液,中和滴定曲线如上图
12. 下列反应离子方程式正确的是
A.溴化亚铁溶液中通入过量氯气:
Fe2+ + 2Br--+ 2Cl2= Fe3+ + Br2 + 4Cl-
B.氯气通入冷的氢氧化钠溶液中:
2Cl2 + 2OH- = 3Cl- + ClO-+ H2O
 C.向澄清石灰水中加入少量小苏打溶液:
C.向澄清石灰水中加入少量小苏打溶液:
Ca2+ + OH-+ HCO3- =CaCO3↓+ H2O
D.氨水中通入过量二氧化硫:
2NH3·H2O + SO2 = 2NH4+ + SO32-+ 2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com