
题目列表(包括答案和解析)
某元素Bi在自然界储量较低,其存在形式有元素态和化合态(主要为Bi2O3和Bi2S3)。Bi是较弱的导体,其电导随温度的升高而降低,但熔触后迅速增加。Bi的熔点是545K,熔融后体积缩小。Bi的沸点为1883K(p=1.014×105Pa),该温度下的蒸气密度为3.011g/L,而在2280K和2770K时蒸气密度则分别是1.122g/L和0.919g/L。
Bi不与无氧化性的稀酸反应,但可被浓H2SO4或王水氧化为硫酸盐或氯化物(Bi的氧化态为Ⅲ)。Bi (Ⅲ)的盐可与碱金属卤化物或硫酸盐作用形成络合物(如BiCl4-、BiCl52-、BiCl63-和Bi (SO4)2-等)。Bi也形成BiN和BiH3等化合物,在这些化合物中,Bi的氧化态为-Ⅲ,Bi还可生成Bi2O4,其中Bi的氧化态为Ⅳ。Bi(Ⅲ)的卤化物也可由Bi和卤素直接反应生成。Bi(Ⅲ)的许多盐可溶解在乙醇和丙酮中。这些盐在强酸性介质中是稳定的,在中性介质中则生成含氧酸盐(羟基盐)沉淀,并渐渐转化成如XONO3的型体。Bi(Ⅲ)的盐在碱性溶液中可被强氧化剂氧化成Bi(V)的化合物,在酸性介质中Bi(Ⅴ)的化合物能将Mn2+氧化为MnO4-。
Bi的化合物有毒。在治消化道溃疡药及杀菌药中含少量Bi的化合物。在碱性介质中,用亚锡酸盐可将Bi的化合物还原为游离态的Bi,这可用于Bi的定性分析。
请回答下列问题:
1.写出Bi原子的电子构型和在门捷列夫元素周期表中的位置;
2.已假定碳原子均匀地分布在铁的晶体结构中;①计算含碳量(质量)为4.3%的马氏体中α一铁的每个晶胞中碳原子的平均数;②计算马氏体的密度(以g/cm3表示)
摩尔质量和常数;MFe=55. 85 g/mol MC=12 g/mol NA=6.02214×1023 mol-1
金属铁的熔点为1811K。在室温和熔点间,铁存在不同的晶型。从室温到1185K,金属铁以体心立方(bcc)的α-铁的晶型存在。从1185K到1667K,铁的晶体结构为面心立方(fcc)的γ-铁。超过1667K直到熔点,铁转化为一种与α一铁的结构相似的体心立方(bcc)结构,称为δ一铁。
1.已知纯铁的密度为7.874g/cm3(293K):①计算铁的原子半径(以cm表示);②计算在1250K下铁的密度(以g/cm3表示)。注意;忽略热膨胀造成的微小影响。注意你所使用的任何符号的原义,例如r=铁原子的半径。
钢是铁和碳的合金,在晶体结构中某些空隙被小的碳原子填充。钢中碳含量一般在0.1%到4.0%的范围内。当钢中碳的含量为4.3%(质量)时,有利于在鼓风炉中熔化。迅速冷却时,碳将分散在α-铁的晶体结构内。这种新的晶体称为马氏体,它硬而脆。尽管它的结构稍有畸变,其晶胞的大小与α一铁晶胞的大小仍然相同。
3. 写出J导入甲和乙的方程式。
2. 写出化学式C、电子式B、结构式E(g)
现有A、B、C、D、E五种固体物质,常温常压下,A、B以物质的量之比2:3混合溶于水,得到溶液甲,同时将产生的气体F、G引爆,无气体剩余;B、C以物质的量之比3:1分别溶于水,产生的气体G、H混合引爆,也无气体剩余,得到一种液体和一种固体;D溶于足量水产生气体I,溶液为乙,将I在足量G中燃烧,产生气体J全部导入溶液乙中,无沉淀生成,若将J导入甲中,产生白色沉淀;加热固体E,在180℃时升华得到E的蒸气,并在273℃时将2.24L E蒸气和0.15mol B固体都导(投)入水中,产生白色沉淀,且测得溶液的溶质只有NaCl;1mol I最多能和2mol F反应,得到的产物很稳定;A、C、E三种物质都含有同一种元素。
1. 写出气体的分子式:
F 、G 、H 、I 、J
2.写出除C以外,分子式为C5H10的所有可能异构体(包括立体异构体,不含构象异构体)。
某化合物A(C5H11Br)有光学活性,A能和NaOH水溶液共热后生成B,B在室温下易被KMnO4氧化,又能和Al2O3共热生成C(C5 H10)。C经K2Cr2O7(H+)作用后生成丙酮和乙酸。
1.写出A、B、C的可能结构式;
已知C一C、C-Cl、C-O、Si-Si、Si-Cl、Si-O键的键能分别为348、339、358、226、391、452kJ/mol。因此有机卤硅烷比卤代烷更容易水解。
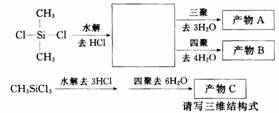 (CH3)3Si-Cl(三甲基氯硅烷)+H2O
(CH3)3Si-Cl(三甲基氯硅烷)+H2O  (CH3)3SiOH(一种硅醇)
(CH3)3SiOH(一种硅醇)
各种硅酸都容易发生分子间失水成Si-O-Si键,而不是生成Si-Si键或Si==O键。
请写出下列产物的结构简式:
3.试求乙二醇试液的浓度(mol/L)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com