
题目列表(包括答案和解析)
5.下列事实与氢键有关的是
A、不加热到很高的温度水难以分解 B、水结冰体积膨胀,密度变小
C、CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D、HF、HCl、HBr、HI的热稳定性依次减弱
4.以水为溶剂进行中和滴定的原理是:H3O++OH- 2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也能发生自电离:2SO2 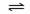 SO32-+SO2+;△H>0。下列叙述中,错误的是
SO32-+SO2+;△H>0。下列叙述中,错误的是
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为SO32-+SO2+ 2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
3、“E85”是含乙醇85%的乙醇汽油。科学家最近的研究表明,大量使用“E85”可能导致大气中O3含量上升,将会对人体造成更直接的伤害。寻找化石燃料新的替代能源又成为化学工作者研究的新课题。下列各项中正确的是 ( )
A.“E85”是由两种物质组成的混合物 B.推广使用乙醇汽油是为了减少温室气体排放
C.等质量的“E85”和汽油充分燃烧后放出的能量相等 D.O3与O2互为同素异形体
2.学习化学时会遇到一些与“相等”有关的规律,下列有关“相等”的说法中正确的是
A.溶液稀释前后,溶质的质量一定相等 B.中和反应中参加反应的酸和碱的质量一定相等
C.微粒中的质子总数和电子总数一定相等D.物质发生化学变化前后分子的总数一定相等
1.在十七大报告中指出:“建设生态文明,基本形成节约能源和保护生态环境的产业结构、增长方式和消费方式……主要污染物排放得到有效控制。”下列做法符合该指导思想的是
A.大量使用合成洗涤剂洗涤衣物
B.大量使用尿素替代碳酸氢铵以提高农作物产量
C.大量使用一次性竹、木筷子以推动林业发展
D.大量利用垃圾生产燃料、肥料“变废为宝”
28.(10分)A、B都是芳香族化合物。1 mol A和1 mol某一元羧酸发生酯化反应生成B。B能在一定条件下发生银镜反应而A不能;A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O;A中氧元素的质量分数为31.6%,B的溶液有酸性但不能和FeCl3溶液发生显色反应。
(1)A、B相对分子质量的差值为_____________________________。
(2)一个A的分子中应有________个氧原子,作出此判断的理由是:
A的分子式是:____________。
(3)B的同分异构体甚多。其中不属于酚类且l mol能与4 mol NaOH反应的同分异构体的结构简式为:__________________(任写一种)。
27.(10分)感光性高分子又称为“光敏性
高分子”,是一种在彩电荧光屏及大规模集成
电路制造中应用较广的新型高分子材料。其结构简式如上:
(1)在一定条件下,该高聚物可发生的反应有 (填代号)
① 加成反应 ② 氧化反应③ 消去反应④ 酯化反应 ⑤ 卤代反应
(2)该高聚物在催化剂的作用下,水解后的产物中有一种相对分子质量较小的R,其分子式为 。
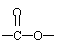 (3)写出R在一定条件下与乙醇反应的化学方程式:
(3)写出R在一定条件下与乙醇反应的化学方程式:
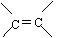 (4)R的同分异构体有多种,其中含有苯环、 和
(4)R的同分异构体有多种,其中含有苯环、 和
且苯环上有两个对位取代基的结构简式是
26.(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
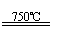 (2)根据“绿色化学”的思想,为了制备H2,设计了下列反应步骤:
(2)根据“绿色化学”的思想,为了制备H2,设计了下列反应步骤:
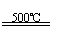
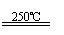 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是
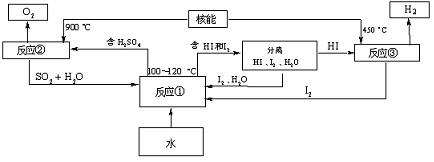
(3)利用核能把水分解制氢气,是目前正在研究的课题。上图是其中的一种流程,其中用了过量的碘,用此法制取氢气最大的优点是:
写出反应①的化学方程式:
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:
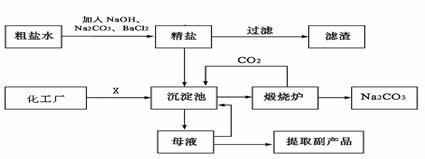 24.(10分) 我国化学家侯德榜,改革国外的纯碱生产工业生产工艺,可简要表示如下:
24.(10分) 我国化学家侯德榜,改革国外的纯碱生产工业生产工艺,可简要表示如下:
(1)为了有效除去粗盐中含有的少量Ca2+、Mg2+、SO42-等杂质,加入试剂的合理顺序为
(2)化工厂提供的X是 ,目的是 生产过程中,需要控制沉淀池温度在30℃-35℃,原因是
(3)煅烧炉发生反应的化学方程式是
(4)该工厂的铁设备易被腐蚀,其正极的电极反应式是
(5)母液可回收利用物质是
25.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气催化反应生成甲醇:
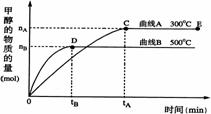 CO(g)+2H2(g)
CO(g)+2H2(g)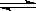 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)500℃从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其它条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度增大 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时C(CH3OH) /C(CO)增大
(4)一定条件下,向上述容器中通入3molCO(g)和5molH2(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的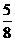 。若相同条件下,向上述容器中分别通入a molCO(g)、b molH2(g)、c mol CH3OH (g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molCO(g)、b molH2(g)、c mol CH3OH (g),欲使达到新平衡时容器内气体压强仍为P(始)的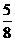 。①a、b、c必须满足的关系是
,
。①a、b、c必须满足的关系是
,
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则b的取值范围是
23.(10分)下图是化学研究小组设计的铜与稀硝酸反应的两个实验装置图。其中装置Ⅰ为甲同学设计。
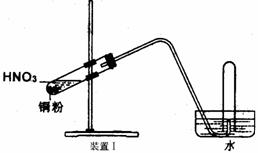
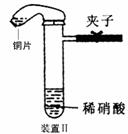
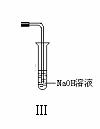
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为
乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是_______________________________________。于是他设计装置Ⅱ。
(2)检验装置Ⅱ的气密性的具体操作和依据是
(3)化学研究小组的其它同学对上述实验进行了研究,认为装置Ⅱ虽然作了改进,但如果按装置Ⅱ进行实验,反应速率较慢,为了解决这个问题,在不加热的条件下,可采取的措施是
(4)按装置Ⅱ进行实验,试管中的气体是淡棕红色,而不是无色。
该采取的措施是:__________________(填具体操作。不能增加装置)。
(5)将装置Ⅱ与Ⅲ连接可避免污染空气,实验结束清洗装置Ⅱ前,应先采取的措施是:__________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com