
题目列表(包括答案和解析)
2.上述反应表明存在哪些官能团?
C臭氧氧化后氧化性水解只得到两个断片,乙酸和直链的二羧酸D。将Q进行类似的断裂,得到草酸和含有一个羧基的物质E。
“蜂皇酸”Q含碳65.2%,氢8.75%,其余为氧。Q具有酸性,43.7mg Q需用23.7rnL 0.0100mol/L氢氧化钠水溶液来滴定达到滴定终点。经测定,Q的分子量不大于200。
1.写出Q的分子式;Q中可能有什么官能团使它具有酸性?
在铂粉存在下Q与氢反应得到新化合物A。A在乙醇中与硼氢化钠反应得到B。B与浓硫酸共热时容易脱水,得到烯烃C。C的13C核磁共振表明在双键上有一个甲基。
5.(NH4)2PtCl6沉淀加热到435℃,只留下金属铂,写出此步的化学反应方程式。
4.写出图中(4)示步骤的离子反应方程式。
3.写出图中(3)示步骤的离子反应方程式。
2.写出阳极泥用王水(一体积浓HNO3与三体积浓盐酸的混合物)处理的化学反应方程式。
从含金、银、铜、铂的金属废料中提取金、银、铂的一种工艺如下图所示:
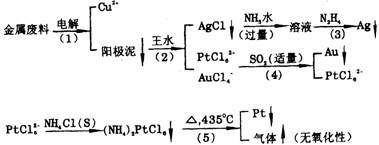
1.电解时,以纯铜为阴极,金属废料为阳极,CuSO4溶液作为电解液,说明为何铜能够与金、银、铂分离?
称取含有Na2S和Sb2S3的试样0.2000g,溶于浓HCl,加热,生成的H2S被50.00mL浓度为0.01000mol/L的酸性碘标准液吸收,此时,H2S被氧化成硫。滴定剩余的碘消耗了0.02000mol/L Na2S2O3标准溶液10.00mL。将除去H2S的试液调为弱碱性,用上述碘标准溶液滴定锑(Sb(Ⅲ)→Sb(Ⅴ)),消耗了10.00mL,写出配平了的有关方程式,计算试样中Na2S和Sb2S3的百分含量。(Na2S和Sb2S3的摩尔质量分别为78.04、339.7g/mol)
2.(7分)贮存的HI溶液和空气中O2作用出现的黄色,可在加入一些Cu粉或通入少量H2S后,过滤又得无色溶液,前者生成白色CuI沉淀,后者形成单质硫。
(1)经Cu粉或H2S处理所得无色HI溶液的浓度比原HI溶液(未经O2氧化,未用Cu或H2S处理的)浓度大、小或不变,简述理由(设溶液体积保持不变)。
(2)又知Cu2+能氧化I-为I2,Cu2+和I-反应的离子方程式为:
(3)H2S和I-(两者的物质的量浓度相近)中还原性更强的是:
(4)Cu2+和H2S相遇时,是否有S生成 ;主要原因是:
1.(9分)市场上出售含碘盐的包装袋上明确写明“煮好菜后下盐保持碘效”及“防潮、防热、避光”贮存。请你根据碘元素在自然界的分布、存在形体以及有关性质对说明书的注意事项加以评论,并设计两种试纸,方便准确地测试含碘盐中碘以IO3-还是I-形还体存在?已知碘化物某些性质如下表所列:
|
|
KI |
NaI |
KIO3 |
NaIO3 |
|
m.p |
681℃ |
661℃ |
560℃ |
分解 |
|
b.p |
1330℃ |
1304℃ |
>100℃开始分解 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com