
题目列表(包括答案和解析)
8.11.87g金属锡跟100 mL2mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)=8mol·L-1,溶液体积仍为100mL。放出的气体在常压下加热到100℃时体积为12.24L。由些推断氧化产物可能是
A.Sn(NO3)2 B. Sn(NO3)4 C.SnO2·4H2O D. Sn(NO3)2和Sn(NO3)4
7.一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(l)===NH4I+NH2At
下列关于AtI性质的叙述正确的是
A.ZnI2既是氧化产物,又是还原产物
B. ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D. AtI与液氨反应,是自身氧化还原反应
6.酸碱批示剂(HIn)在水溶液中存在以下电离平衡:HIn(红色) H++In-(黄色)。请判断浓度为2×10-2
mol·L-1的下列溶液:①盐酸 ②澄清石灰水 ③氢化铵溶液 ④硫酸氢钠溶液 ⑤亚硫酸氢铵溶液 ⑥磷酸二氢铵溶液 其中能使该指示剂显红色的是
H++In-(黄色)。请判断浓度为2×10-2
mol·L-1的下列溶液:①盐酸 ②澄清石灰水 ③氢化铵溶液 ④硫酸氢钠溶液 ⑤亚硫酸氢铵溶液 ⑥磷酸二氢铵溶液 其中能使该指示剂显红色的是
A.①④⑥ B.①②③④⑤⑥ C.①③④⑤ D.其他组合
5.主链为4个碳原子的某烷烃有2种同分异构体。则与这种烷烃具有相同的碳原子数、主链上也为4个碳原子的单烯烃,共有异构体
A.3种 B.4种 C.5种 D.2种
4.“拟晶”是一种具有凸多面体规则外形但不同于晶体的固态物质。Al65Cu23Fe12是二十世纪发现的几百种似晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是
A. Al65Cu23Fe12的硬度比金属Al、Cu、Fe都大
B. Al65Cu23Fe12中三种金属的化合价均可视作零
C. Al65Cu23Fe12不可用作长期浸泡在海水的材料
D.1 mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
3.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合液中,生成沉淀与通入CO2的量的关系可表示为
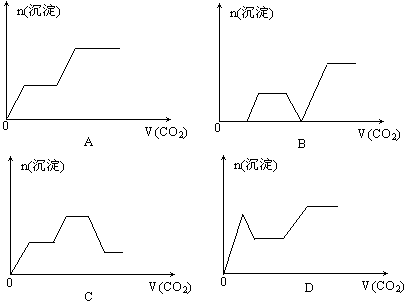
2.用即热饭盒盛装食物,可以得到热烘烘的饭菜。原因是即热饭盒的底部装入了混有镁、铁粉末的高密度聚乙烯,进行简单的操作后,水和镁就会发生剧烈的化学反应,放出热量便可使食物变热。其中铁可能是
A.一种反应物 B.催化剂 C.起导热作用 D.增大镁与水分子接触机会
1.我国科学家为一个比头发丝还细的小分子恢复了磁性,由此创造了一项“世界第一”。实验时将一种名为“钴酞菁”的小分子搬上了“手术台”。这个“个头”仅为1.3纳米的小分子,其结构和性质与人体内的血红素及植物体内的叶绿素非常相似,在光电子器件、生物技术等方面具有广泛而重要的应用与研究价值。下列说法正确的是
A.“钴酞菁”的小分子没有胶体的性质
B.纳米材料可以应用于所有化工领域
C.现在纳米器件都是无所不能的胶体
D.此工作实现了利用局部的化学反应来改变和控制分子的物理性质
26.(14分)有许多现象,你去留心观察,分析思考,会发现一些有趣问题,从中发现规律。如下系列芳香族有机物,各项排列构成一个等差数列。请回答有关问题:
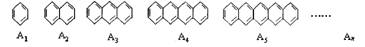
(1)写出上面等差数列的第n项芳烃分子式。
(2)某课外兴趣小组,做了系列实验。他们将该数列的前五项芳烃逐一加到浓的酸性高锰酸钾溶液中加热。结果发现,只有A1无明显变化,其余四种物质都能使酸性高锰酸钾溶液褪色。经分析知,后四种的氧化产物是 或者两者都有。由此你能得出什么结论?
或者两者都有。由此你能得出什么结论?
(3)甲、乙、丙三同学同做酸性高锰酸钾溶液氧化A5的实验。甲将氧化后的混合液酸化分离得到一种无色晶体X,称取0.2540gX,用热水配成100mL溶液,取出25mL用0.1mol L-1NaOH溶液中和滴定,滴到10mL时达到终点;丙用酸性高锰酸钾溶液氧化A5,将氧化后的混合液酸化分离得到无色晶体Y,中和测定知Y的中和能力比X的中和能力弱得多;乙用酸性高锰酸钾溶液氧化A5,将氧化后的混合液酸化分离得到无色晶体,经分析其中包含了甲与丙获得的两种成份。通过计算确定X的结构简式。
(4)仔细分析该系列芳烃的二氯取代物异构体的数目,很有规律性。请你分析推出An的二氯取代物种数的代数表达式。


25.(10分)实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520g样品中加入碳酸氢钾溶液、0.13%I2的氯仿溶液,在分液漏斗中振荡15min。离子方程式为: SO32-+I2+2HCO3-===SO42-+2I-+2CO2↑+H2O
②取①中所得的水溶液,加人一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250mL溶液。
③在②所得溶液中取25mL,滴加甲酸,除去其中过量的Br2。
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液。离子方程式为:6H++IO3-+5I-===3I2+3H2O
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120 molL-1 Na2S2O3 15.10mL。离子方程式为: I2+2S2O32-===2I-+S4O62-
回答下列问题;
(1)写出②、③三步操作中所发生反应的离子方程式。
② ,③ 。
(2)①中为什么要用0.13%I2的氯仿溶液,而不直接用I2的水溶液? 。
(3)计算样品中亚硫酸钠的质量百分含量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com