
题目列表(包括答案和解析)
13.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81 g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀。由此可推断出X的化学式为( )
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3
D.K2SO4· Cr2(SO4)3
Cr2(SO4)3
12.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
A.负极反应为:14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围PH升高
C.每消耗1 mol C2H6,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
11.甲苯加到汽油中可增加汽油的辛烷值。空气与甲苯蒸气的体积比约为以下何值时,甲苯可发生完全燃烧( )
A.9∶1 B.11∶1
C.26∶1 D.43∶1
10.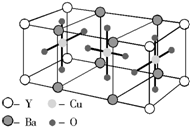 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是( )
A.1 mol该化合物中有1 mol Y
B.1 mol该化合物中有6 mol O
C.1 mol该化合物中有2 mol Ba
D.该化合物的化学式是YBa2Cu3O6
9.下列各组离子在溶液中能大量共存,当溶液呈强酸性时,有气体产生;而当溶液呈强碱性时,又能生成沉淀。该组离子可能是( )
A.Na+、Cu2+、NO3-、CO32- B.NH4+、K+、Cl-、HCO3-
C.Mg2+、NH4+、SO42-、Cl- D.Fe2+、Na+、SO42-、NO3-
8.类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中不正确的是( )
A.钠、镁都是活泼金属,由金属钠和镁引起火灾都不能用干冰灭火器灭火
B.NaHSO3溶液能与NaAlO2反应生成白色沉淀,NaHCO3溶液也能与NaAlO2反应生成白色沉淀
C.NH4Cl、NH4I结构相似,将两种固体分别加热,都分解生成HX和NH3
D.原电池中通常是活泼金属做负极,不活泼金属做正极,用铜和铝与浓硝酸构成原电池时,铝是负极
7.下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- H2O+NH3↑
H2O+NH3↑
C.实验室制Fe(OH)3胶体:Fe3++3OH-=Fe(OH)3(胶体)
D.次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
6.对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,一定有CO32-或SO32-
B.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.某气体能使湿润红色石蕊试纸变蓝,该气体一定显碱性
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
5.阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是( )
A.1 L 0.1 mol/L的FeCl3溶液中,H+的数目约为6.02×1015
B.1 mol金刚石中含有C-C键的数目约为6.02×1023
C.7.8 g Na2O2中含有的阴离子数目约为6.02×1022
D.标准状况下,1 L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)×6.02×1022
4.2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR'。若让丙烯发生上述“复分解反应”,最不可能生成的新烯烃是( )
A.2-丁烯 B.1-丁烯 C.乙烯 D.丙烯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com