
题目列表(包括答案和解析)
4] C
3] B
2] B
1] B
15].在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出。化学式中OH为氢氧根,而M、A、D、E代表四种未知元素。已知:⑴x+y+z=12(x、y、z为正整数)。⑵取9.7g该化合物溶于含有稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转变为白色沉淀,过滤干燥后称量为9.32g。⑶滤液中A、M以阳离子形式存在,用胶头滴管滴滤液2~3滴在白色点滴板(或玻璃片)上,再滴加1~2滴硫氰化钾溶液,溶液呈血红色。⑷往滤液中通入足量的硫化氢气体,使A离子全部被还原后,产生黄色沉淀物,过滤干燥后,称量为0.96g。⑸化合物中A元素的百分含量为34.64%。试通过计算推理判断:
(1) 确定D和E:D是__________,E是__________(写元素符号)。
(2) 确定x、y、z和A:x=________,y=________,z=________,A是________。
(3) M代表的元素是________;化合物的化学式为____________________。
14]. Al和Si、Ge和As在元素周期表金属和非金属过渡位置上,在其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1) As 的价层电子构型为
(2) AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体A12C16形式存在,其中铝原子与氯原子的成键类型是
(3) 超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与______个N原子相连,与同一个Al原子相连的N原子构成的空间构型为____________。在四大晶体类型中,AlN属于________晶体。
(4) Si和C 同主族,Si、C和O成键情况如下:
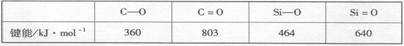
在C和O之间可以形成双键形成CO2分子,而Si和O则不能和碳那样形成有限分子原因是___________________________________________________________________。
(5) SiCl4(l)常用作烟雾剂,原因Si存在3d轨道,能同H2O(l)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理_____________________________________。
13].《有机化学基础》
①醛(如糠醛)在碱作用下,可以发生如下反应:

②不饱和碳碳键上连有羟基不稳定。
③化合物A~F之间的转化关系如下图所示。其中,化合物A含有醛基,E与F是同分异构体,F能与金属钠反应放出氢气。A生成F的过程中,A中醛基以外的基团没有任何变化。
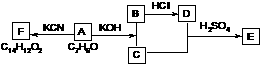
据上述信息,回答下列问题:
(1) 写出A生成B和C的反应式:
(2) 写出C和D生成E的反应式:
(3) F结构简式是
(4) A生成B和C的反应是 ,C和D生成E的反应是
A.氧化反应 B.加成反应 C.消去反应 D.酯化反应 E.还原反应
(5) F不可以发生的反应有________________
A.氧化反应 B.加成反应 C.消去反应 D.酯化反应 E.还原反应
12].《化学反应原理》
I.室温下,将等体积CH3COOH溶液和NaOH溶液混合。
(1) 若混合溶液中c(H+)=c(OH-),则混合前c(CH3COOH)______c(NaOH),混合前CH3COOH溶液中c(H+)______NaOH溶液中c(OH-)(填“>”或“<”或“=”)。
(2) 若混合溶液的溶质为CH3COONa和NaOH,则下列关系可能正确的是 。
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(CH3COO-)>c(Na+)>c(OH-)>c(H+) ④c(Na+)>c(CH3COO-)> c(H+)> c(OH-)
II.在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1) 写出该反应平衡常数的表达式 ,2分钟内B 的平均反应速度为
____________________;
(2) 若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应;
(3) 若将容器体积缩小至1升,反应达到平衡时C的浓度为________mol/L,平衡常数________(填“增大”、“减小”或“不变”)。
11].碳酸钠和碳酸氢钠是重要的工业原料。某学生活动小组为探究它们的性质并测定某天然碱的成分进行了下述实验。
Ⅰ. 向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)_______________;向上述溶液中滴入过量CaCl2溶液,观察到的现象是_____________________________。
Ⅱ. 某天然碱的组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)。现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g。实验时忽略装置内空气中的CO2和水蒸气。
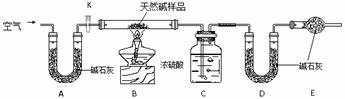
请回答:
(1) 在用托盘天平称量样品时,如果天平指针向左偏转,说明__________________;
(2) NaHCO3受热分解的化学方程式为______________________________________;
(3) E处碱石灰的作用__________________________________________;
(4) 反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是____________________;
10]. 下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.在常温下,10mL 0.02mol·L-1HCl溶液与10mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com