
题目列表(包括答案和解析)
13.硫-钠原电池具有输出功率较高、循环寿命长等优点。
其工作原理可表示为:2Na+xS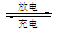 Na2Sx。
Na2Sx。
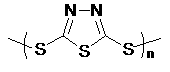 但工作温度过高是这种高性能电池的缺陷,科学家研究发现采用多硫化合物(如右图)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是 ( )
但工作温度过高是这种高性能电池的缺陷,科学家研究发现采用多硫化合物(如右图)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性。下列关于此种多硫化合物的叙述正确的是 ( )
A.这是一种新型无机非金属材料
B.此化合物可能发生加成反应
C.原电池的负反应将是单体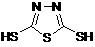 转化为
转化为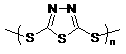 的过程
的过程
D.当电路中转移0.02mol电子时,将消耗原电池的正极反应材料1.48g
12.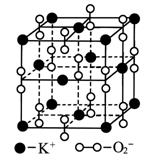 高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为-2价。下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是 ( )
高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为-2价。下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是 ( )
A.晶体中与每个K+距离最近的K+有12个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.超氧化钾的化学式为KO2每个晶胞含有14个K+和13个O2-
D.晶体中,0价氧原子与-2价氧原子的数目比可看作为3:1
11.下列离子方程式不正确的是 ( )
A.三氯化铝溶液中加人过量氨水 Al3++3OH- Al(OH)3↓
Al(OH)3↓
B.4mol/L的NaAlO2溶液和7mol/L的HCI等体积互相均匀混合
4AlO2-+7H++H2O 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C.在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液
5PbO2+2Mn2++4H+ 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
D.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L 25mL Na2CO3溶液中,并不断搅拌
2H++CO32- CO2↑+H2O
CO2↑+H2O
10.已知某饱和溶液的以下条件:①溶液的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度。其中不能用来计算该饱和溶液的物质的量浓度的组合是 ( )
A.④⑤⑥ B.①②③④ C.①③④ D.①③④⑤
9.经测定某溶液中离子只有Na+、Ac-、H+、OH-四种,且离子浓度大小的排列顺序为:c(Ac-)>c(Na+)>c(H+)>c(OH-)。其可能的情形是 ( )
A.该溶液由pH=3的HAc与pH=11的NaOH溶液等体积混合而成
B.0.2mol/L的HAc溶液与0.1mol/L的NaOH溶液等体积混合
C.在上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:
c(Ac-)>c(Na+)>c(OH-)>c(H+)
D.该溶液由0.1mol/L的HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成
8.某溶液可能含有Na+、Ag+、A13+、AlO2-、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列结论中不正确的是 ( )
A.此溶液中一定有S2-、SO32-、Na+ B.此溶液中可能有AlO2-、CO32-
C. 此溶液中一定没有Ag+、A13+ D.此溶液中可能有S2-、NO3-
7.Al(OH)3是一种难溶于水的物质,只要溶液中Al3+物质的量浓度(mol/L)和OH‑物质的量浓度(mol/L)3次方的乘积大于1.9×10-33,就会析出Al(OH)3沉淀,则0.10mol/L AlCl3不产生沉淀的最大OH-物质的量浓度(mol/L)为 ( )
A.1.9×10-33 B.2.7×10-11 C.8.7×10-8 D.1.2× 10-11
6.下列哪种物质的中心原子的最外层不是8电子结构 ( )
A.CO2 B.NF3 C.PF5 D.OF2
5.下列说法正确的是 ( )
A.Na2O2、Na2O均能吸收CO2并放出氧气
B.Mg、A1、Fe均能在冷的浓硝酸中钝化
C.SO2和C12的漂白原理相同
D.SiO2既能与NaOH又能与Na2CO3反应生成Na2SiO3
4.下列操作或实验数据记录正确的是 ( )
A.1mol/L的AgNO3溶液和1mol/L的KI溶液混合制碘化银胶体
B.用标准NaOH溶液滴定未知浓度的盐酸用去NaOH溶液23.10mL
C.用pH试纸测得氯水的pH为2
D.在试管中制备Fe(OH)2时,将吸有NaOH溶液的滴管插入试管里FeSO4溶液的底部
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com