
题目列表(包括答案和解析)
27. (4分)以铜为阳极,石墨为阴极,用含3-5gNaOH的15%NaCl的混合溶液做电解液,外加电压为1.5V电解时,得到一种半导体产品(产率93%以上)和一种清洁能源,则它的阳极反应式为 ① ,阴极反应式为 ② ;电解也是绿色化学中一种有效工具,试以此为例,写出绿色化学的两点特征: ③ 和 ④ 。
26. (3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在烧杯中央滴入CuSO4溶液。
(3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在烧杯中央滴入CuSO4溶液。
⑴经过一段时间后,观察到的现象是(指金属圈)▲。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
⑵产生上述现象的原因是 ▲ 。
25.现有反应:
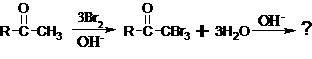
下面物质中是该反应的主要产物的是
A.CHBr3
B.HOCBr3 C.  D.
D. 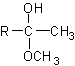
24. 对于反应F2+H2O=HOF+HF而言,下列说法中正确的是
A.由含氧酸的定义可知,HOF是次氟酸
B.在反应产物中,氟的氧化数分别为+1、-1
C.在上述反应中,氟气既是氧化剂,又是还原剂
D.在该反应中,水是还原剂
23.下面反应中,不能合成1-丙醇的是
A. CH3CH2COOH 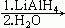 CH3CH2CH2OH
CH3CH2CH2OH
B. CH3CH=CH2
 CH3CH2CH2Br
CH3CH2CH2Br  CH3CH2CH2OH
CH3CH2CH2OH
C. CH3CH2Br 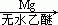 CH3CH2MgBr
CH3CH2MgBr  CH3CH2CH2OH
CH3CH2CH2OH
D. CH3CH=CH2  CH3CH2CH2OH
CH3CH2CH2OH
22. 下列关于2SO2+ O2 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是
A. 增加O2,有利于平衡正向移动 B. 催化剂有利于平衡正向移动
C. 增大压强有利于平衡正向移动 D. 通入N2有利于平衡正向移动
⒈我国有些煤矿的坑道中具有丰富的可燃性气体。目前已建成利用坑道气的发电厂,这样既充分利用了能源,又保证了煤矿的安全生产,坑道中的可燃性气体是
A.H2 B.CO C.CH4 D. CH4 和CO的混合气体
⒉A是烷烃,B是单烯烃,B分子中的碳原子数比A分子中多。常温下1L该混合气体充分燃烧可得到同温同压下的二氧化碳气体2.5L,则原混合气体中A和B的组合方式可能有
A.2和 B.3和 C.4和 D.5和
⒊某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜丝,经充分反应后气体体积又减小,但还有气体剩余。以下对混合气体组分的判断中,正确是
A.一定有N2、HCl,没有CO B.一定有N2,CO和HCl中至少有一种
C.一定有N2、CO和HCl D.一定没有N2,CO和HCl中至少有一种
⒋设硫酸为二元强酸,现有0.01mol/LH2SO4溶液滴定0.01mol/L NaOH溶液,中和后加至100mL。若滴定终点判断有误差:①多加了1滴H2SO4溶液;②少加了1滴H2SO4溶液(1滴溶液的体积约为0.05mL),则①和②两种情况下溶液中[H+]之比的值是
A.10 B.50 C.5×103 D. 104
⒌下列电子排布式中,属于第121号元素的是
A.[118]5g18s2 B.[118]8s28p1 C.[118]7d18s2 D.[118]6f18s2
⒍在呈强酸性的无色溶液中,能大量共存的离子组是
A.Al3+、Cu2+、SO42-、Cl- B.Na+、K+、CO32-、NO3-
C.NH4+、Mg2+、SO42-、Cl- D.Ag+、Ca2+、Cl-、NO3-
⒎已知在pH值为4左右的环境中,Ca2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
A.加入纯Cu将Fe2+还原为Fe
B.向溶液中通入H2S使Fe2+沉淀
C.向溶液中通入Cl2,再通入NH3,调节pH值为4左右
 D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4左右
D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4左右
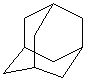
⒏金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右图所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是
A.4种 B.6种 C.8种 D.10种
⒐在配平P4+CuSO4+H2O→Cu3P+H3PO4+ H2SO4时,H2O前面的化学计量数应为
A.60 B.70 C.85 D.96
⒑下列离子方程式正确的是
A.等物质的量的Ba(OH)2与明矾加入足量水中
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸
 Fe(OH)3+3H+= Fe3++3H2O
Fe(OH)3+3H+= Fe3++3H2O
C. H218O中投入Na2O2固体
2H218O+ 2O22-=4OH-+ 18O2↑
D.CuCl2溶液中加入NaHS溶液
Cu 2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
 ⒒某钾(·)的石墨嵌入化合物沿c轴的投影图如图,该化合物的化学式为
⒒某钾(·)的石墨嵌入化合物沿c轴的投影图如图,该化合物的化学式为
A.KC12 B. KC10 C. KC8 D. KC6
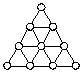
⒓右图是正四面体的原子簇Aun一个三角面图,根据该图,确定Aun中的n数值为
A.47 B.18 C.19 D.20
⒔下面二维平面晶体所表示的化学式为AX3的是
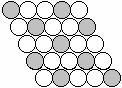
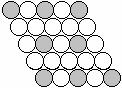
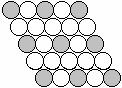
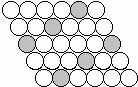
A. B. C. D.
⒕Na2SO4溶液的溶解度曲线如右图,下列说法错误的是
A.A点表示Na2SO4溶液尚未达到饱和,但降温或加入Na2SO4固体都可使其饱和
B. Na2SO4的溶解度随着温度的升高而增大
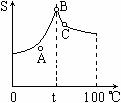 C.在t℃时给Na2SO4饱和溶液降温或升温,都会使其溶液变浑浊
C.在t℃时给Na2SO4饱和溶液降温或升温,都会使其溶液变浑浊
D.制取芒硝的最佳方法是在100℃时配成Na2SO4的饱和溶液,并降温至0℃,可析出Na2SO4·H2O晶体
⒖分子中含有n个碳碳双键的烯烃的分子量为M,wg该烯烃和标准状况下VL的H2恰好完全反应,则每摩尔该烯烃的分子中所含碳碳双键的数目为(NA表示阿伏加德罗常数)
A. B.
B.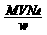 C.
C. 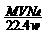 D.
D. 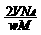
⒗下面官能团在芳香苯环的取代反应中,不是邻、对位定位基团的是
A.-R(烷基) B.-OH C. 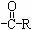 D.-NH2
D.-NH2
⒘在20%的NaOH溶液中,用丙酮在100℃条件下与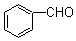 反应得到的主要产物是
反应得到的主要产物是
A. 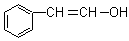 B.
B. 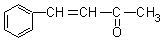
C. 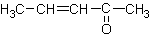 D.
D. 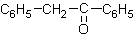
⒙下面有机物中,无顺反异构体的是
A.(CH3)2C=CHCH3 B. CH3CBr=CHC2H5
C. CH3CH=CHCH3 D. CH3CH=CHC2H5
⒚下面反应中,主要产物为.(CH3)3C-OCH3(甲基叔丁基醚)的是
A. (CH3)3C-ONa+CH3I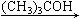 B.
B. 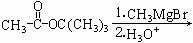
C. (CH3)3CCl+KOCH3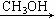 D.
D. 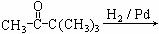
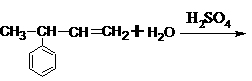
⒛反应 的主要产物是
A. 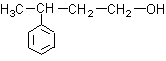 B.
B. 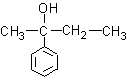
C. 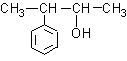 D.
D. 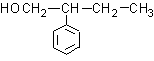
21.反应(CH3)3C-OH 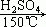 的主要产物是
的主要产物是
A. (CH3)3C-C-C(CH3)3 B. (CH3)3CH
C. (CH3)2C=CH2 D.CH2=CH-CH=CH2
26.(9分)高温超导材料的研究是21世纪材料领域的热点问题,YBaCuO体系一直是此领域的研究重点之一。将钇(Y)、钡、铜的氧化物按一定的物质的量之比混合(Y为ⅢB族元素),再经高温煅烧可得到复合氧化物YBa2Cu3O6.5+δ,实验证明:该物质具有超导性能,其零电阻温度可达90K,化学式中的δ大小与超导性能密切相关。有一种观点认为δ的产生源于体系中产生了Cu3+。
(1) 经测定δ一般不大于0.50,按此推算,Cu3+占物质中总铜量的质量分数最大为多少?
(2) 已知可用间接碘量法测出体系中Cu3+的质量分数,该法涉及的化学反应有:
4Cu3++2H2O 4Cu2++O2+4H+,2Cu2++4I‑
4Cu2++O2+4H+,2Cu2++4I‑ Cu2I2+I2,2S2O32-+I2
Cu2I2+I2,2S2O32-+I2 S4O62-+2I-等。
S4O62-+2I-等。
现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L,的Na2S2O3,滴定至终点,消耗Na2S2O3的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+的质量分数为多少?m值为多少?
2005年全国高中学生化学竞赛(江苏赛区)预赛试题
25.(6分)2005年是DNA结构发现52周年。DNA(脱氧核糖核酸)是生物体的重要组成物质,在它的碱基对中储存着遗传信息,与生物的生长、发育等正常生命活动以及癌变、突变等异常生命活动密切相关。因此,研究DNA的结构与功能的关系,将有助于人们从分子水平上了解生命现象的本质,并从基因水平上理解某些疾病的发病机理,从而使通过分子设计寻找有效的治疗药物成为可能。
研究工作者通常选取动物体外模拟的方法来对所合成的药物分子进行初步研究,如小牛胸腺常被选为实验材料。由于小牛胸腺不仅DNA含量高,而且其脱氧核糖核酸酶(DNase)的活性较低,在制备过程中由此酶引起的DNA降解损失也较小。为了防止DNase的作用,常在提取它的缓冲液中加入一定量的EDTA(乙二胺四乙酸)螯合剂,以除去保持DNase活性的一种金属离子Mn+(生成1: 1的M n+-EDTA螯合物)。
实验发现该金属离子在DNase中含量相当于此金属在空气中燃烧所得灰烬溶于60mmol的盐酸中,且过量的盐酸需用12mmol的NaOH才能完全中和,然后在此溶液中加入过量碱蒸馏,逸出的氨通到10 mmol的盐酸中,剩余的酸需用6 mmol的NaOH中和。该金属离子电子数与Ne相同,但多2个质子。请回答以下问题:
(1) 此金属离子是什么?
(2) 需要加入多少毫摩尔的EDTA恰好除去DNase中的金属离子?写出计算过程。
(3) 如果在药物分子作用下,DNA发生开环(链)反应,你认为它是吸收能量还是放出能量?为什么?
24.(12分)化合物A分子组成为C5H9Br,可以吸收1 mol溴生成B,B的组成为C5H9Br3。A容易与NaOH水溶液作用,得到互为同分异构体的两种醇C和D。C加氢后的产物易被氧化,而D加氢后的产物不易被氧化。A与KOH-C2H5OH溶液作用得到分子组成为C5H8的化合物E。E经高锰酸钾硫酸溶液氧化得到丙酮酸:
(1) 写出A-E的结构简式:
A ,B ,C ,
D ,E ;
(2) 化合物D的系统命名为 ;
(3) 组成为C5H8的直链烃的同分异构体数目为 (不包含立体异构)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com