
题目列表(包括答案和解析)
6、下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用洒精中
A、②③①④ B、③②①④ C、③①②④ D、①②③④
5、 二氧化氮存在下列平衡:2NO2(g) N2O4(g);⊿H<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是
二氧化氮存在下列平衡:2NO2(g) N2O4(g);⊿H<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是
A、温度130℃、压强3.03×105Pa B、温度25℃、压强1.01×105Pa
C、温度130℃、压强5.05×104Pa D、温度0℃、压强5.05×104Pa
4、下列反应中,调节反应物用量或浓度不会改变反应产物的是
A、硫化氢在氧气中燃烧 B、铁在硫蒸气中燃烧
C、二氧化硫通入石灰水 D、硫酸中加入锌粉
3、0.05mol某单质与0.8g硫在一定条件下完全反应,该单质可能是
A、H2 B、 O2 C、K D、Zn
2、钛(Ti)金属常被称为未来钢铁。钛元素的同位素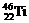 、
、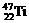 、
、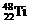 、
、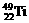 、
、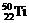 中,中子数不可能为
中,中子数不可能为
A、30 B、28 C、26 D、24
1、下列物质中,可用于治疗胃酸过多的是
A 、碳酸钠 B、氢氧化钠 C、氧化钠 D、碳酸钡
45、a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数 (单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示) (3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属 (5)c微粒是 ,f微粒是
(用化学式表示)
44、W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y。W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1:1,Y原子最外层s电子与p电子数之比为1:1,Z原子核外电子中p电子数比Y原子多2个。
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为 < (用分子式表示)。
(3)这四种元素原子半径的大小为 > > > (填元素符号)
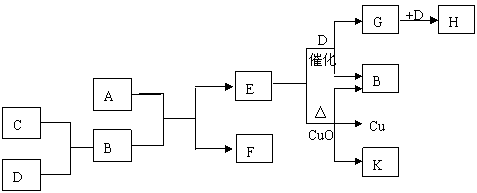
43、A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol-1,甲元素的原子最外层电子数与K层相等,乙元素的氢化物水溶液显碱性。C为单质,其原子半径在周期表中最小。D为气体,其密度为相同条件下空气密度的1.103倍。K为乙元素的单质。在适当的条件下,它们之间有如下图所示的转化关系:
试填写下列空白:
⑴ 甲元素的单质在空气中燃烧可得到_____________(填化学式)。
K分子的结构式为___________
⑵ 完成下列有关反应的化学方程式
E + D  G + B
_______________________________________
G + B
_______________________________________
E + CuO: ___________________________
⑶ E与G在一定条件下若能反应,写出化学方程式;若不能,则说明理由。
____________________________________________________
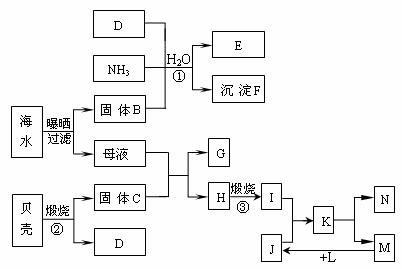
42、江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质。
试填写下列空白:
⑴N的化学式为: ;
⑵写出反应①的化学方程式: ;
⑶由K溶液经如何处理才能制得N?
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com