
题目列表(包括答案和解析)
26.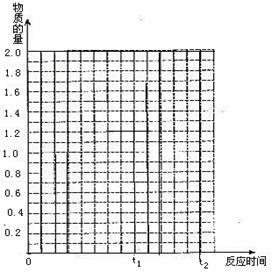 (9分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
(9分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 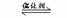 2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
⑴反应进行到t1时,SO2的体积分数为 。
⑵若在t1时充入一定量的氩气(Ar),SO2的物质的量将 __________(填“增大”、“减小”或“不变”)。
⑶若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“<”、“>”或“=”),并简单说明原因 ________________________________________________________________________
⑷若其它条件不变,在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,在图中作A从t0→t1→t2点这段时间内SO2的物质的量变化曲线。
25、(9分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。

(1)写出E的电子式:_____________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式: _______________________。
24、(10分)固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。试回答下列问题:
(1)固体A属于 晶体,它的电子式为_________________;
(2)判断A溶于水后,溶液显 性(填酸性或碱性),
解释其原因 (用化学方程式表示);
(3)A与铜或铜的某些化合物在一定条件下可合成CuH。 CuH是一种难溶物,它能与盐酸反应,放出气体。请写出这个反应的化学方程式: _________________________________。
23.(13分)(某地有软锰矿(主要成份为MnO2,含少量Al2O3、SiO2)和闪锌矿(主要成份ZnS,含少量FeS、CuS、CdS、SiO2),科研人员采用新工艺生产二氧化锰和锌,同时还得副产品镉和X、Y、Z等。工业流程图如下图(框图中水省略):
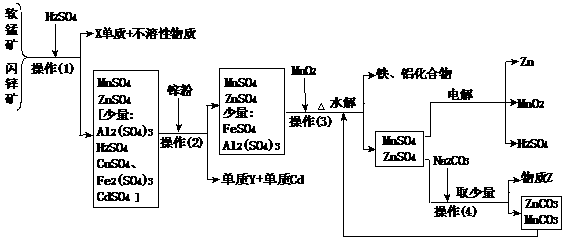
请回答:
(1)副产品X的名称是 ,Y的名称是 、Z的化学式为 。
(2)他们的主要产品中的元素在周期表中,锌属 族,X在 周期。
(3)图中“操作(1)~(4)”都包含的共同一种操作,在实验室中该操作的名称为 。
(4)操作(1)中,在稀H2SO4存在下MnO2把硫化物氧化成硫单质和+2价硫酸盐。如果硫化物用MS表示,请写出MnO2与硫化物反应的化学方程式: 。
(5)操作(3)生成的铁、铝化合物的化学式为 。
(6)请写出电解制得锌和二氧化锰的化学方程式 。
(7)旧工艺生产二氧化锰,是将软锰矿与煤混合粉碎后高温焙烧,再用硫酸浸取焙烧料净化后电解。对比旧工艺,新工艺有好多个优点,请你至少说出新工艺的一个优点:
。
22、(13分)某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。已知:①NO + NO2 + 2OH- = 2NO2- + H2O;②气体液化温度:NO2:21℃、NO:-152℃
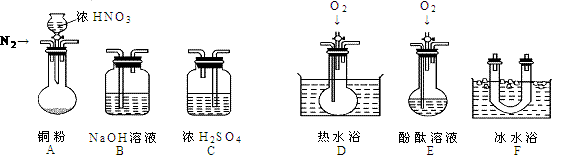
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”)
甲:________; 乙:________; 丙:_________
具体说明不能验证的主要原因(能验证的方案,不必回答原因):
甲方案:_________________________________________________。
乙方案:_________________________________________________。
丙方案:_________________________________________________。
(2)实验开始时首先通入足量的N2,其目的是:__________________________。
(3)确认气体中含NO的现象是:________________________________ 。
(4)如果O2过量,则装置B中发生反应的离子方程式是:____________________________。
21、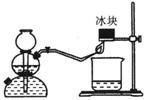 (4分)众所周知,氢气燃烧生成水。然而,资料表明,氢气燃烧时除生成水外,还生成另一产物。某同学用如图所示的实验装置,验证该产物的存在。 实验步骤及现象如下:
(4分)众所周知,氢气燃烧生成水。然而,资料表明,氢气燃烧时除生成水外,还生成另一产物。某同学用如图所示的实验装置,验证该产物的存在。 实验步骤及现象如下:
制H2、验纯,将火焰对着冰块。
①在小烧杯内加入用硫酸酸化的稀KI淀粉溶液,将小
烧杯放在冰块下方,观察到烧杯中溶液由无色变成了蓝色。
②在另一个小烧杯内加入用硫酸酸化的稀KMn04溶液,将小烧杯放在冰块下方,观察
到烧杯中溶液变成了无色。
(1)另一产物的结构式为 ;
(2)由上述实验中可以归纳出该产物的化学性质有 。
20.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),
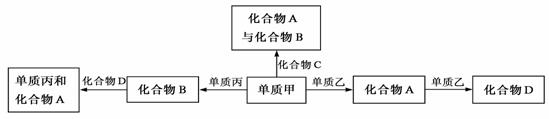
以下结论不正确的是
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体均是分子晶体
D.上图所示的五个转化关系中,均为放热反应
19.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到
D.镁粉在水的催化下与溴发生反应
18.下列有关铁元素的叙述中正确的是
A.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
B.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI FeI3+3H2O
FeI3+3H2O
C.氢氧化铁可以由相关物质通过化合反应而制得
D.铁元素位于周期表的第四周期第ⅧB族
17.下列各组离子,在指定的条件下能大量共存的是
A.滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl- 、NO3-
B.水电离出来的c(OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
C.PH为11的溶液:S2-、SO32-、 S2O32-、Na+
D.所含溶质为NaCl的溶液:K+、SiO32-、NO3-、Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com