
题目列表(包括答案和解析)
7.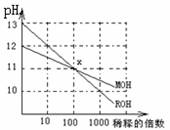 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示,下列叙述中正确的是
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示,下列叙述中正确的是
A.MOH和ROH都是强碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10c(MOH)
D.常温下,pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
6.保护环境是每一个公民的责任。下列说法正确的是
A.大量使用含磷洗涤剂会带来“白色污染”
B.减少并逐步停止生产和使用氟氯代烷的目的是为了减少酸雨
C.废旧电池中的汞、镉、铅等重金属盐不会对土壤和水源造成污染
D.一个现代的化工企业,应该朝着无废物排出的“封闭式生产”的方向努力
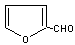
28.(10分)已知:HCN的结构为H -C≡N。

 R-CN RCOOH, R-Cl+CN- R-CN+Cl-(R为烃基)
R-CN RCOOH, R-Cl+CN- R-CN+Cl-(R为烃基)
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛 , 它是重要的化工原料,它在一定条件下可发生以下变化:
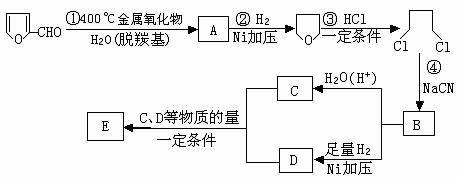
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式 。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
27. (10分)已知:①R-
-; ;②苯环上原有的取代基对新导入的取代基进
(10分)已知:①R-
-; ;②苯环上原有的取代基对新导入的取代基进
入苯环的位置有显著影响.当一取代苯进行取代反应时,新引进的取代基因受原取代基的影响而取
代邻、对位或间位。使新取代基进入它的邻、对位的取代基有-CH3、-NH2;使新取代基进入它的
间位的取代基有-COOH、-NO2;以下是用苯作原料制备一系列化合物的转化关系图:

⑴A转化为B的化学方程式是______________________________________________。
⑵图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②_______________________________。
⑶B在苯环上的一氯代物有 种同分异构体。
⑷有机物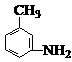 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
26.(12分)在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼
出1.0 kg的二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。
方法一:有的科学家提出“金属过氧化物处理系统”,即不断的将座舱内的空气通过盛有金属过
氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式为:
① ,② ;
将处理后的气体充入座舱时,应注意采取的一项措施是 。
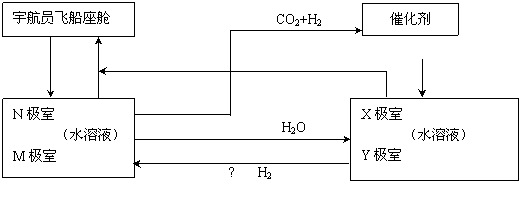 方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
① ② ③ CO2还原系统
O2
电化学二氧化碳处理系统 电解水系统
⑴管道①把飞船座舱内含有较多二氧化碳的潮湿的空气通入“电化学二氧化碳处理系统”的N
极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为 ,
其电解产物吸收二氧化碳的离子反应方程式为 。在N极吸收二氧化碳
后形成的离子会通过隔膜进入M极室,通过M极的电极反应可以使二氧化碳从电解液中释放出来,
并保持系统的pH不变;该电极反应式为 、 。
⑵管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通入飞船座舱内供宇航
员呼吸用。在“电解水系统”中Y为 极(填“阴”或“阳”)X极的电极反应为 。
⑶逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。在该系统内,
二氧化碳跟氢气在一定条件下反应,其产物中有甲烷等气体,请评价这种处理的意义
25.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成
的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)
反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的
氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组
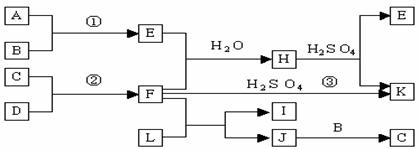 成,其相对分子质量为32。请按要求填空:
成,其相对分子质量为32。请按要求填空:
⑴反应③的化学方程式 。
⑵C的结构式 ;H的化学式 。
⑶L的溶液与化合物E反应的离子方程式 。
⑷化合物J的化学式 。
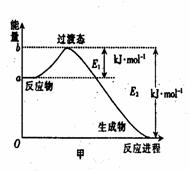
24.(8分)⑴20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理
论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的
过渡态。图甲是1mol白磷(P4)和足量O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)
和O2反应生成P4O10的热化学方程式:
(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
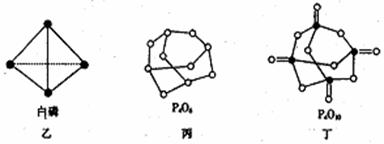
⑵白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间
插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个
氧原子(如图丁)。请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
⑶进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简
单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/ kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982kJ/mol,
白磷完全燃烧的产物结构如图丁所示,则上表
中x=_________。
⑷写出1 mol P4与O2反应生成固态P4O6的反应热△H=_____________。
23.(10分)某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸
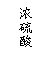
 的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
⑴甲组同学拟选用下列实验装置完成实验:
①该组同学必须选用的装置的连接顺序是A接( )( )接( )( )接( )(填
接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能
顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?______________ _。
⑵乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,
也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存
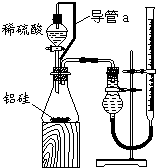 在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是__________________ _ _。
②实验中准确测得4个数据:实验前铝硅合金的质量m1 g,
实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别
为V1 mL、V2 mL。则通常状况时气体摩尔体积Vm=_____ L·moL-1。
21(10分)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
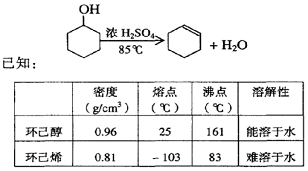
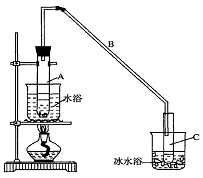
⑴制备粗品:将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢
加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________。
⑵制备精品:①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、
分层,环己烯在_____层(填上或下),分液后用______(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
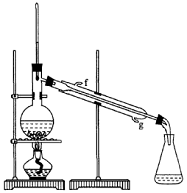 ②再将环己烯按右图装置蒸馏,冷却水从____口进入。蒸馏时要加入生石灰,目的是 。
②再将环己烯按右图装置蒸馏,冷却水从____口进入。蒸馏时要加入生石灰,目的是 。
③收集产品时,控制的温度应在_________左右,实验
制得的环己烯精品质量低于理论产量,可能的原因是 。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
⑶以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
22.(10分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”
(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人
 体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子
反应方程式是 , ;
⑵加入试剂2后溶液中颜色由淡黄色转变为淡红色的是因为 ,请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因 ;
⑶该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为
该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答)
;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
20.500℃、20Mpa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2
和NH3物质的量变化如图所示,下列说法正确的是
A.从曲线变化可以看出,反应进行到10 min至20 min钟时可能是使用了催化剂
B.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L· min)
C.从曲线变化可以看出,反应进行至25 min钟时,分离出0.1 mol的氨气
D.在25 min钟时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
第II卷(非选择题,共80分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com