
题目列表(包括答案和解析)
11.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a Y(g)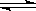 b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
A、a=1,b=1 B、a=2,b=1 C、a=2,b=2 D、a=3,b=2
10.某盐Na2R2O3·5H2O遇酸分解,具有还原性,R2O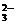 的结构如图所示。其中两个R处于不同的价态,则R①和R②的价态分别是:
的结构如图所示。其中两个R处于不同的价态,则R①和R②的价态分别是:
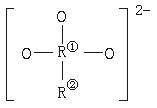
A.+3,-1 B.+6,-2 C.+4,-1 D.-3,+1
9.下列比较正确的是:
A.熔沸点高低:NH3<PH3<AsH3<HI
B.离子半径大小:Br-<Mg2+<Cl-<F-
C.分散质微粒直径大小:Fe(OH)3胶体>NaCl溶液
D.酸性强弱:H2SO3>CH3COOH>H2CO3>H2SiO3
8. 某种氯化镁晶体有24Mg2+、35Cl–、37Cl–、三种离子组成,在熔融状态下,使1mol这种氯化镁完全电解,测得产生的气体质量为同体积氧气质量的2.22倍。则这种氯化镁晶体中35Cl–与37Cl–与的物质的量之比为:
A.1:2 B.2:3 C.1:3 D.3:1
7. 1
mol有机物 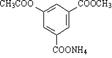 与足量NaOH 溶液充分反应,消耗NaOH 物质的量为:
与足量NaOH 溶液充分反应,消耗NaOH 物质的量为:
A.5 mol B.4 mol C.3 mol D.2 mol
6.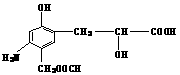 分析有机物的结构
分析有机物的结构
应具有的性质是:①缩聚反应 ②加成反应 ③取代反应 ④水解反应 ⑤中和反应 ⑥显色反应 ⑦氧化反应 ⑧还原反应 ⑨消去反应:
A.只③⑤⑥⑦ B.只④⑤⑥⑦
C.全部 D.除①④外其余都有
5.下列实验需使用温度计的是:
A.实验室蒸馏石油 B.用浓盐酸制氯气 C.实验室制乙炔 D.结晶硫酸铜结晶水含量的测定
4.下列变化能显著放热的是:
A.Ba(OH)2·8H2O晶体和NH4Cl晶体的反应 B.Na2O2与H2O的反应
C.灼热的碳与二氧化碳的反应 D.NH4NO3晶体溶于水
3.工矿企业必须严格执行关于“三废”排放标准,并且尽可能地把“三废”变成有用的副产品,否则将会严重地污染环境。下列有关工业生产中的“三废”因任意排放,可能导致“光化学污染”的是:
A.硫酸工业废气 B.工业生产硝酸的尾气
C.工业电镀锌的废水 D.火力发电厂的废渣
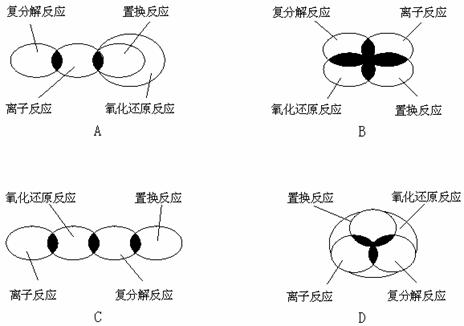
2.离子反应、复分解反应、置换反应和氧化还原反应之间用集合关系可表示为:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com