
题目列表(包括答案和解析)
5.生活中的问题常涉及到化学知识,下列叙述中不正确的是
A.用汽油、煤油除去油污时发生的主要是物理变化
B.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D.棉花、蚕丝和人造丝的主要成分是纤维素
25.水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO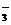 的水所形成水垢的化学组成,取干燥的水垢3.16 g,加热使其失去结晶水,得到2.89
g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到5.91
g沉淀。
的水所形成水垢的化学组成,取干燥的水垢3.16 g,加热使其失去结晶水,得到2.89
g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到5.91
g沉淀。
(1)通过计算确定A中是否含有碳酸镁;
(2)2.89 g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重1.41 g,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐的质量分数。
24.在标准状况下将c molCl2通入含a molFeBr2、b molFeI2的溶液中,当c取不同值时,反应后所得溶液中有不同溶质(不考虑生成物与水的反应)。
(1)下表中空格填满:
|
c的取值(用含a、b的代数式表示) |
反应后溶液中溶质的化学式 (只要求写盐类化合物) |
|
|
FeBr2、FeI2、FeCl2 |
|
b≤c<(a +3b)/2 |
|
|
|
FeBr3、FeCl3 |
|
|
FeCl3 |
(2)若a =b =1 、c =2时,反应后溶液中属于盐类的溶质是 (写化学式),这些溶质的物质的量之比是 ;
(3)若a =b =1 、c =2.5时,写出Cl2通入溶液中总的离子方程式(限写一个,但需包括所有的离子反应): 。
23.(12分)M5纤维是美国开发的-种超高性能纤维,在相同的防护级别下,M5纤维比现有的防破片材料轻35%,且防热和防火性能十分出色。据报道,美军士兵佩带的头盔、防弹背心和刚性前后防护板在战争中保住了许多美军士兵的生命。M5纤维是刚杆形又有强力分子间氢键的聚合物,当z是聚合物主链方向时,在x方向与y方向的氢键是其晶体结构的特征。下面是M5纤维的合成路线:(有些反应未注明条件)
请思考:(1)合成M5的单体的结构简式F ______________,G ______________;
(2)反应类型:A→B______________,B→C______________;
(3)A的同时可能生成的同分异构体______________。
(4)写出化学反应方程式:
C→对苯二甲酸:__________________________________ ;
(5)1mol的F与 NaHCO3溶液反应,最多耗NaHCO3_________ mol;
(6)怎样理解M5纤维分子间有强力氢键?
。
22.(8分)汽车制动液(俗称刹车油)是汽车安全行驶的重要保证,人们称其为“安全卫士”。刹车油既要耐高温、又要抗低温,要达到要求必须用聚乙二醇醚作原料。植物的秸杆、甘蔗渣等富含纤维素,通常农民都在收获季节将它们烧掉,既造成浪费,又严重地污染环境。科学研究发现,它可以代替粮食和乙烯,作为乙醇的重要来源。再将乙醇经过处理,最终可以得到制得刹车油的主要原料--聚乙二醇醚HO(CH2CH2O)n H。
(1)写出纤维素中所含有的决定其主要用途的官能团的名称 。
(2)由葡萄糖转化为乙醇的催化剂为 。
(3)由乙醇制乙二醇的过程中,发生反应的类型为 。
(4)写出由乙二醇制聚乙二醇醚的化学反应方程式 。
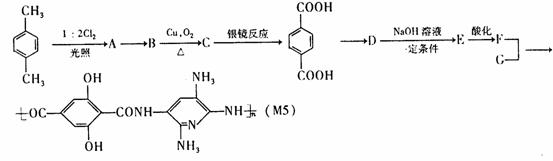
21 .(8分)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,
.(8分)20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,
N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。已知E(N-N)=167kJ·mol-1,E(N=N)=418kJ·mol-1,E(N≡N)=942kJ·mol-1。(E表示键能,即打开1mol气态化学键所需要的能量)回答下列问题:
(1)N60分子中每个N原子最外层有 个电子;
(2)N60稳定性较差的原因可能是 ;
(3)1molN60受热分解为N2时放出的热量为 ;
(4)N60潜在的商业用途可能是 。
20.(10分)下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中
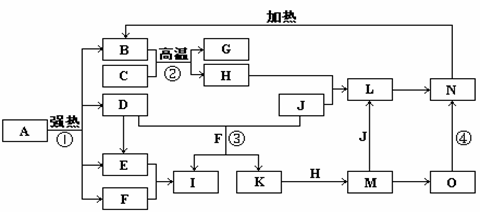
最常见的金属单质,J是气态非金属单质,O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志(图中部分反应物和生成物没有列出)。请按要求回答:
(1)写出L的化学式 ;
(2)写出:反应③的离子方程式 ;
反应④的化学方程式 ;
(3)反应②在工业生产上的用途是 ;
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 。
19.(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,C的非金属性最强,
B、C同周期,A、D同主族隔周期,E元素原子最外层的电子数是D元素的最外层层电子数的三倍。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________________ ,
C元素在周期表中的位置是__________________。
(2)C和D的离子中,半径较小的是__________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ _
(4)C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是 。


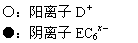


18.(14分)亚铁是血红蛋白的重要组成部分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是薄衣片,……,与VC(维生素C)同服可增加本品吸收。某同学设计实验对其中的铁成分进行了验证。请一起完成实验:
第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2、和SO42-,也可以将Fe2+ 氧化成 Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色混浊液,说明有 存在(填离子符号)。
第三步:往上述溶液中滴入几滴KSCN溶液出现浅红色,说明溶液中有少量Fe3+存在。该离子存在的原因可能是(填序号):
① 药品中的铁本来就以Fe3+的形式存在:
② 在制药过程中生成少量Fe3+;
③ 本实验过程中有少量Fe3+生成。
第四步:将第三步所得溶液分成两份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示) 、
红色又逐渐褪去的原因可能是
请自选中学实验室中常用仪器、药品,设计实验证明你的推测
。
第六步:向B试管的溶液中加入一片VC,片刻后溶液红色也褪去,说明VC有 性
怎样理解药品说明书中所述“与VC(维生素C)同服可增加本品吸收”这句话?
。
17.(8分)下图为中学常用定量仪器的部分结构(有的仪器被放大),回答下列问题:
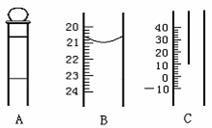
⑴ 中和热测定实验中应用到上述仪器中的 (填序号),该仪器在中和热测定实验中放置的位置是 ;
⑵ 配制一定物质的量浓度溶液的实验中应用到上述仪器中的 (填序号),如果读数时视线偏高,则所得溶液的物质的量浓度将 (填“偏大”“偏小”或“不变”);
⑶ 测定某待测浓度时,一般用 手操作B仪器。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com