
题目列表(包括答案和解析)
3.据报道,2006年11月一名俄罗斯前特工在英国因钋中毒而死亡。已知钋单质为银白色金属,在黑暗中能发光,它有两种不同结构的单质α-Po和β-Po,钋元素有质量数从192到218的全部核素,其常见化合价为+2、+4、+6。下列关于钋的叙述错误的是( )
A.钋元素的放射性元素 B.α-Po和β-Po是钋元素的同素异形体
C.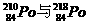 互为同位素 D.210Po和218Po为两种不同的元素
互为同位素 D.210Po和218Po为两种不同的元素
2.有关化学用语正确的是 ( )
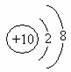 A.乙炔的最简式C2H2 B.蔗糖的化学式C12H22O11
A.乙炔的最简式C2H2 B.蔗糖的化学式C12H22O11
C.乙醛的结构简式CH3COH D.钠离子的结构示意图为
1.威海的城市建设日新月异,高楼林立,马路宽阔,绿树成荫,鸟语花香。你是否注意到,马路两旁的许多树干上都抹上了白石灰。下列有关说法不正确的是 ( )
A.氢氧化钙显碱性,能使蛋白质变性,所以有防治树木病虫害作用
B.利用白石灰的反光作用,降低晴天吸热,减少昼夜温差,预防树皮冻裂
C.饱和石灰水加入生石灰,若温度不变,则pH不变
D.饱和石灰水加入生石灰,若温度不变,则Ca2+的物质的量不变
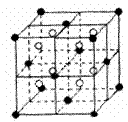 28A.(10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物
28A.(10分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物
两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
 (1)A和D的氢化物中,沸点较低的是 (填“A”或“D”);
(1)A和D的氢化物中,沸点较低的是 (填“A”或“D”);
A和D的电负性较大的是 (填“A”或“D”);
B和C的第一电离能较小的是 (填“B”或“C”);
A和B的离子中,半径较小的是 (填离子符号);
元素C的原子核外电子排布式为 ;
C单质的晶体中原子以 键相结合。
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:
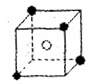
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如上图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。该化合物的化学式是
(4)已知晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并
计算,结果保留一位小数。____________________________
28.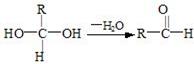 B(10分)已知:
B(10分)已知:
请根据下图回答
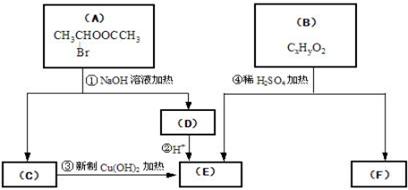
(1)E中含有的官能团的名称是__________________;③的反应类型是_____________ ,C跟新制的氢氧化铜反应的化学方程式为:
。
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为_________________,F的分子式为______________。
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11μm线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为:
。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________种结构,写出其中任意一种同分异构体的结构简式 __________________。
27.(8分)质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的化学式为_____________。
已知该物质可能存在多种结构,A.B.C是其中的三种,请根据下列要求填空:
(2)A与氢气加成生成2-甲基戊烷,则A的可能结构有___________种。
(3)B能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则B的结构简式为:________________________
(4)C不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则C的结构简式为:____________________________
26.(12分)(1)Xe和F2在一定条件下发生反应,Xe +F2 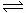 XeF2;XeF2+F2
XeF2;XeF2+F2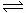 XeF4;XeF4+F2
XeF4;XeF4+F2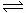 XeF6;可得XeF2、XeF4、XeF6三种气态氟化物。当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小。当压强为700kPa、温度达到1250℃时,测得XeF2的体积分数约为95%。那么,为了有效地制备XeF2,你认为应该采取的合适措施是 。
XeF6;可得XeF2、XeF4、XeF6三种气态氟化物。当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小。当压强为700kPa、温度达到1250℃时,测得XeF2的体积分数约为95%。那么,为了有效地制备XeF2,你认为应该采取的合适措施是 。
(2)据报道,在﹣55℃,将XeF4(X)和C6F5BF2(Y)化合,可得一离子化合物(Z),测得Z中Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中含有Y的苯环,Z是首例有机氙(Ⅳ)的化合物,﹣20℃以下稳定。Z为强氧化剂,如与碘反应得到五氟化碘,放出氙,同时得到Y。据此回答(要求化合物Z以离子形式表示):
①写出合成Z反应的化学方程式 。
②写出Z和碘反应的化学方程式 。
(3)英国化学家以巴特莱特将等物质的量的PtF6与Xe混合在室温下反应,制得第一个稀有气体化合物六氟合铂酸氙:Xe ﹢ PtF6 ﹦ XePtF6。该化合物极易与水反应,生成氙、氧气和铂的+4价氧化物等。已知生成物氙和氧气的物质的量之比为2﹕1、。试写出XePtF6水解反应的化学方程式 。
(4)现将二份等质量的XeF2和XeF4的混合物进行如下实验:
①一份用水处理,得到气体A和溶液B,A的体积为56.7mL(标准状况,下同),其中含O222.7mL,其余为Xe。B中的XeO3能氧化30.00mL浓度为0.1000mol∕L的(NH4)2Fe(SO4)2。(XeO3被还原为Xe)
②另一份用KI溶液处理,生成的I2用0.2000mol∕L的Na2S2O3溶液滴定,共用去35.00mL。
已知反应 I2 + 2S2O32- == S4O62- + 2I- , 试求混合物中XeF2和XeF4的物质的量。
25.(11分)I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)⇋Fe(s)+CO2(g) ΔH>0。其平衡常数可表达为k =c(CO2)/c(CO),已知1100℃时,k=0.263。
(1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
 (2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态
(填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原因是
(2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态
(填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原因是
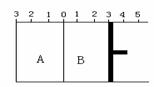
II.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g)  2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA , B中压强为PB,则PA与PB的关系是PA _____ PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
③若活塞右移到5处,达到平衡后,B中SO3为x mol,
A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)。
24. (7分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1). 若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是: 第四周期,第Ⅷ族 。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:
AlCl+3HOAl(OH)↓+3HCl↑ 。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为_Al-3e-+4OH-===AlO-+2HO 。
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙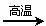 丙。则:
丙。则:
①甲的结构式为O==C==O。
②写出上述反应的化学方程式O+C2CO 。
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式_3CO+4OH-===2HCO-+CO2-+HO(2分,写为其它形式的均不给分)
23.(13分)为测定碳酸钙纯度(设含杂质SiO2),同学们设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;(2)加入过量盐酸;(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品
M g;(2)用c mol/L 盐酸 V mL(过量)溶解样品;(3)取溶解后的溶液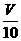 mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
[方案III](1)称取碳酸钙样品 M g;(2)把样品高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M/ g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”? ;
问题2:本方案中的“冷却”应如何操作 。
[方案IV](1)称取碳酸钙样品 M g;(2)加入足量c mol/L盐酸V mL使之完全溶解;(3)过滤并取滤液;(4)在滤液中加入过量c′mol/L Na2CO3溶液V′mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M/ g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′mL
B.精确配制浓度c′mol/L Na2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度
将 (偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
22.(12分) 学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算为标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:(1)在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________
(2)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是___________________________________。
VI 实验结论:_____________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com