
题目列表(包括答案和解析)
20.(10分)A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物,甲和乙的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜进行机械加工。已知:
(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。
(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体。
(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。
(图中部分生成物没有列出。)
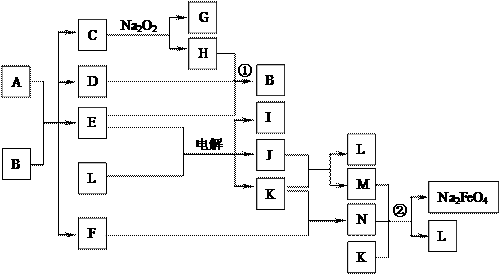
请填写以下空白:
⑴写出C的结构式 。
⑵写出反应①的化学方程式 。反应②的离子方程式 。
⑶甲和乙的化学式分别为 、 ,若A中化合价显负价和显正价的元素物质的量之比为4∶9,则乙在A中的物质的量分数为 。
19.(10分)氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有两种:
第一种方法:无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
①电解池中阳极反应的方程式是 。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种方法:无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是 ,猜测该反应能够进行的原因是 。
④已知下列各物质的价格如下表:
|
物质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
|
价格(元/50kg) |
500 |
1900 |
4200 |
26000 |
10600 |
从经济效益分析,上述方法中的第 种方法不好,理由是 。
(四)红色沉淀探究
该同学设计了四种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化。
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣。
 方案Ⅲ:称得干燥坩埚a g ,取红色粉末置于坩埚中再称得质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为c g,比较a、b、c的关系。
方案Ⅲ:称得干燥坩埚a g ,取红色粉末置于坩埚中再称得质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为c g,比较a、b、c的关系。
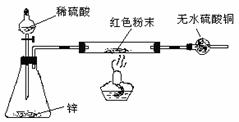
方案Ⅳ:装置如右图所示:(夹持仪器略去)试回答 下列问题:
(1) 请你评价方案Ⅰ和方案Ⅱ。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
评价方案Ⅰ
评价方案Ⅱ
(2)方案Ⅲ中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
(3)方案Ⅳ中,要测定红色粉末的成分,必须测定下列哪些物理量 (填序号)。
①通入氢气体积 ② 反应前,红色粉末+反应管的总质量 ③实验前干燥管的质量④完全反应后,红色粉末+反应管的总质量 ⑤反应管的质量 ⑥ 锌粒质量 ⑦ 稀硫酸的物质的量浓度 ⑧实验后干燥管的质量 ⑨实验条件下的大气压强和室温
(4)有人提出:方案Ⅳ中,在氢气发生器与反应管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由 。
(三)制备红色沉淀:①制备氢氧化铜悬浊液 ②氢氧化铜悬浊液与葡萄糖共热 ③过滤、洗涤、低温烘干得红色粉末。
(二)查阅资料:①Cu2O属于碱性氧化物; ②Cu+在酸性条件下能发生自身氧化还原反应;
③在空气中灼烧Cu2O能生成CuO。
(一)提出猜想: 。
17.(10分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
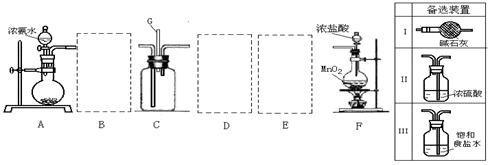
请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________ D__________ E__________(均填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵: 。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理? 。
18.(12分)某同学对课本实验结论:“葡萄糖与新制氢氧化铜共热生成红色的Cu2O沉淀”提出质疑,认为红色沉淀不一定就是氧化亚铜。为了确定红色沉淀的成分,开展了研究。
16.过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等,钨的最高价为+6价。现有钨酸钠晶体(Na2WO4·2 H2O,相对分子质量为330)0.990g加水溶解后,再加入一定量的锌和稀H2SO4,反应生成一种蓝色化合物(可看作含+5价、+6价混合价态的钨的氧化物)且无H2产生。现用0.044mol/L KMnO4酸性溶液滴定这种蓝色化合物恰好将其氧化为一种黄色化合物,KMnO4中的+7价锰被还原成Mn2+,共耗去KMnO4酸性溶液8.20mL(已知在酸性条件下氧化性;KMnO4>+6价的W的化合物)。上述蓝色化合物是
A.W10O21 B.W8O22 C.W10O27 D.W5O14
第Ⅱ卷(非选择题,共86分)
15.25℃时,在25 mL o.1 mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
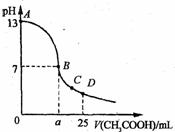 A.B点的横坐标a>12.5
A.B点的横坐标a>12.5
B.C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间任一点,溶液中都有:
c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
14.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应产生
① IO3-+5I-+6H+=3I2+3H2O ② 3I2+3 HSO3-+3H2O=6 I-+3 HSO4-+6H+
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失,这一反应称为时钟反应,有人用它来解释生物钟现象。下列有关说法中错误的是
A.在整个反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液颜色突然变蓝,随之又很快消失”这一现象与①、②反应速率有关
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com