

题目列表(包括答案和解析)
5.某校化学课外活动小组利用下面所提供的仪器装置和药品制取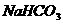 溶液,设计如下实验。实验室提供的药品、仪器装置如下:
溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀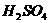 ④饱和
④饱和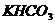 溶液 ⑤浓
溶液 ⑤浓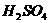 ⑥
⑥ 固体 ⑦
固体 ⑦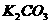 粉末仪器装置(如图13所示):
粉末仪器装置(如图13所示):
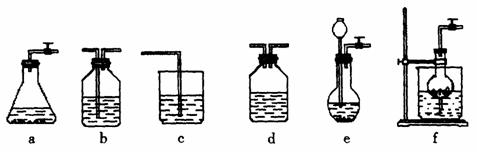
图13
请根据题目要求回答下列问题:
(1)请按下表要求,填写选择的装置和药品。

(2)如何检验所选择的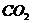 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:
_____________________________________________________________________________
_____________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量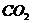 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量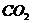 后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
后,Z装置内的溶液中离子浓度大小顺序为_______________________;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过_____________%(质量分数)。
附:有关物质在常温(20℃)时的溶解度
|
化学式 |
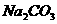 |
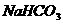 |
NaOH |
NaCl |
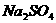 |
溶解度(g/100g ) ) |
21.3 |
9.60 |
107 |
35.8 |
19.4 |
4.下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
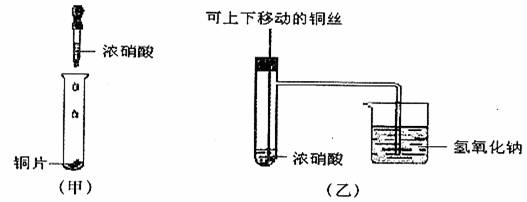
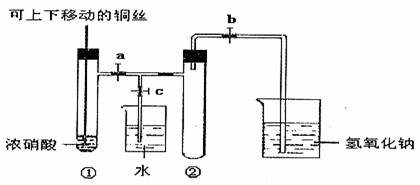
(丙)
(1)写出铜和浓硝酸反应的化学方程式______________________________________。
(2)和甲装置相比,乙装置的优点_____________________________________________
____________________________________________________________________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹_______,再打开弹簧夹______________,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作______________________________________________________________________
____________________________________________________________________________。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是_________________________(气体按标准状况计算)。
3.(16分)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质
m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
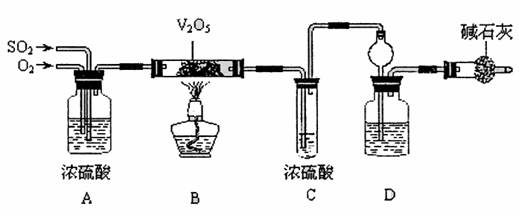
请回答下列问题:
(1)已知0.5 mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
。
(2)检查完装置的气密性且加入药品后,开始进行实验,此时首先应进行的操作是
。
(3)实验时A中氧气导冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是
;装置C中浓硫酸的作用为 ;
装置D中盛放的溶液中足量的 (选填字母)。
a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(4)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(5)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为wg。若装置D增加的质量为ag,则此条件下二氧化硫的转化率是
(用含字母的代数表示,结果可不化简)。
2.(15分)下图中,甲由C、H、O三种元素组成,元素的质量比为12:3:8,甲的沸点为78.5℃,
其蒸气与H2的相对密度是23。将温度控制在400℃以下,按要求完成实验。
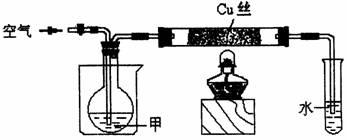
(1)在通入空气的条件下进行实验Ⅰ。
①甲的名称是 ,加入药品后的操作依次是 。
a.打开活塞 b.用鼓气气球不断鼓入空气 c.点燃酒精灯给铜丝加热
②实验结束,取试管中的溶液与新制的Cu(OH)2混合,加热至沸腾,实验现象为
。
③现用10%的NaOH溶液和2%的CuSO4溶液,制取本实验所用试剂Cu(OH)2,请简述实验操作。
。
(2)在停止通入空气的条件下进行实验Ⅱ。
①关闭活塞,为使甲持续进入反应管中,需要进行的操作是
。
②甲蒸气进入反应管后,在铜做催化剂有250~350℃条件下发生可逆的化学反应,
在试管中收集到了实验Ⅰ相同的产物,并有可燃性气体单质放出。该反应揭示了甲
催化氧化的本质。写出实验Ⅱ中反应的化学方程式,并结合该化学方程式简要说明实验Ⅰ中所通空气的作用。
1.某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
|
(1) 草酸晶体 |
分子式 |
H2C2O4·2H2O |
颜色 |
无色晶体 |
|
熔点 |
100.1℃ |
受热至100.1℃时失去结晶水,成为无水草酸。 |
||
|
(2) 无水草酸 |
结构简式 |
HOOC-COOH |
溶解性 |
能溶于水或乙醇 |
|
特性 |
大约在157℃升华(175℃以上发生分解)。 |
|||
|
化学性质 |
H2C2O4
+ Ba(OH)2 =BaC2O4↓+ 2H2O |
|||
|
HOOC-COOH >175℃
CO2↑+CO↑+H2O↑ |
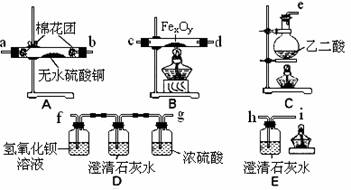 该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接 h 。
(2)该组同学进行了下列实验操作:
① 点燃B处的酒精灯;
② 检查实验装置的气密性并装入药品;
③ 反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;
④ 点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤ 点燃尖嘴i处的酒精灯。
正确的实验操作顺序是: 。
(3)收集气体验纯的目的是 。
D装置中澄清石灰水的作用是 。
E装置中澄清石灰水的作用是 。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00 g,样品FexOy的质量为7.84 g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y= 。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。
4、错误地理解△H中+、-号的意义。
(各位同学可把自己的易错知识归纳补充于此。)
3、忽视物态对热化学方程式中△H的影响(如水的固、液、气态)
2、忽视题目中要求的限定
如:要求表达燃烧热、中和热等,系数就不能任意改变
1、可逆反应中计量系数与实际反应量的问题
已知热化学方程式:N2(g)+3
H2(g) 2 NH3(g);ΔH=-92.2 kJ·mol-1
2 NH3(g);ΔH=-92.2 kJ·mol-1
现有a、b两个反应器,a中充入1 mol N2与3 mol H2,b中充入1 mol N2与6 mol H2,反应放出的热分别是Qa和Qb,则 ( )
A.Qa<Qb<92.2 kJ B.Qa=Qb<92.2 kJ
C.Qa=Qb=92.2 kJ D.Qa<Qb=92.2 kJ
右图A为直流电源,B为渗透饱和
氯化钠溶液和酚酞试液的滤纸,C为电镀槽,
接通电路后,发现B 上的 C 点显红色,
请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,
使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为: ,槽中盛放的镀液可以是 或
 (只要求填两种电解质溶液)。
(只要求填两种电解质溶液)。
(1)正 (2)2NaCl+2H2O H2↑+Cl2↑+2NaOH
(3)Zn-2e = Zn2+, Zn2++2e = Zn,ZnSO4溶液或ZnCl2溶液
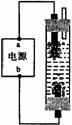 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
15、(05广东)一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是
A、在熔融电解质中,O2-由负极移向正极
B、电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O
C、通入空气的一极是正极,电极反应为:O2 + 4e- = 2O2-
D、通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2-= 4CO2 + 5H2O
(特别注意O在电极反应方程式中书写的变化)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com