
题目列表(包括答案和解析)
19.答案:A
解析:白磷燃烧生成P4O6的反应热取决于断开P-P键和O==O键所吸收的能量与形成P-O键所放出的能量。断键需吸热,成键要放热。
ΔH=-(12×360-6×198-3×498)kJ·mol-1=-1638kJ·mol-1。
19.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图1所示。现提供以下化学键的键能:P-P:198 kJ·mol-1,P-O:360 kJ·mol-1,O==O:498 kJ·mol-1。则反应:P4(白磷)+3O2====P4O6的反应热ΔH为

图1
A.-1638kJ·mol-1 B.+1638kJ·mol-1
C.-126kJ·mol-1 D.+126kJ·mol-1
18.答案:D
解析:A中,分散系微粒粒度在1-100 nm之间的为胶体,小于1 nm的为溶液,大于100 nm的为浊液;B中,在溶液中n(OH-)/n(Al3+)=3:1时恰好生成Al(OH)3沉淀,n(OH-)/n(Al3+)=4:1时恰好生成Na[Al(OH)4],故n(OH-)/n(Al3+)<3时,反应后Al元素的存在形式为Al3+和Al(OH)3,3<n(OH-)/n(Al3+)<4时,Al元素的存在形式为[Al(OH)4]-和Al(OH)3,n(OH-)/n(Al3+)>4时,Al元素的存在形式为[Al(OH)4]-;C中,铁与稀硝酸反应按n(Fe)/ n(HNO3)≤1:4时,生成Fe3+,n(Fe)/ n(HNO3)≥3:8时,生成Fe2+,在1:4-3:8之间既有Fe3+,又有Fe2+,故A、B、C正确。D中,CO2通入澄清石灰水中反应:n(CO2)/ n[Ca(OH)2] ≤1:1时生成CaCO3,n(CO2)/ n[Ca(OH)2]≥2:1时生成Ca(HCO3)2,在1:1-2:1之间既有CaCO3,又有Ca(HCO3)2。故D错误。
18.化学与数学有密切的联系,将某些化学知识用数轴表示,可以受到直观形象、简明易记的良好效果。下列用数轴表示的化学知识中错误的是
A.分散系的分类
 分散系微粒直径(nm)
分散系微粒直径(nm)
B.AlCl3溶液中滴加NaOH溶液后Al元素的存在形式
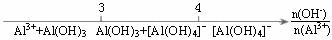
C.铁与稀硝酸反应后溶液中铁元素的存在形式

D.CO2通入澄清石灰水中反应的产物
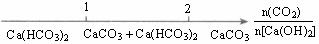
17.答案:C
解析:由题中信息NaHSO3溶液呈酸性(电离为主)、NaHCO3溶液呈碱性(水解为主),可知A项和D项错误;B项应为电荷守恒关系式,但c(RO32-)前应乘2,故B项错;由电离守恒与物料守恒得:
① c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),
② c(HRO3-)+c(RO32-)+c(H2RO3)=c(Na+),
①式+②式可得c(H+)+c(H2RO3)=c(RO32-)+c(OH-),所以C项正确。
17.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C)。其中正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
16.答案:C
解析:①中Ca2+与CO33-、SO42-不能大量共存,②中为碱性条件,各离子能大量共存,③中水电离的H+浓度为10-12mol·L-1的溶液,可能显酸性,也可能显碱性。CO32-、SO32-与H+反应,NH4+与OH-反应,不能大量共存,④中为酸性溶液,各离子能大量共存,⑤中为酸性溶液,Fe2+被MnO4-和NO3-氧化,不能大量共存,⑥中Fe3+、Al3+ 和S2-双水解,不能大量共存。
16.下列各组离子能在指定溶液中,能大量共存的是
①无色溶液中:K+,Cl-,Ca2+,CO33-,SO42-,NO3-
②pH=11的溶液中:CO32-,Na+,[Al(OH)4]-,NO3-,S2-,SO32-
③水电离的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-,CO32-,NO3-,NH4+,SO32-
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使石蕊变红的溶液中:Fe2+,MnO4-,NO3-,Na+,SO42-
⑥中性溶液中:Fe3+,Al3+,NO3-,I-,Cl-,S2-
A.①②⑤ B.①③⑥ C.②④ D.①②④
15.答案:C
解析:A中滴定管是碱式滴定管,错误;B中NH4Cl受热分解产生的NH3与HCl在冷却后会重新反应生成NH4Cl,得不到NH3,错误;D中量筒不是配制溶液的仪器,且浓硫酸的稀释放出大量的热量,不能在量筒中进行,错误;C中避免了二价铁道氧化,正确。
15.下图所示对实验仪器名称的标注或实验操作正确的是
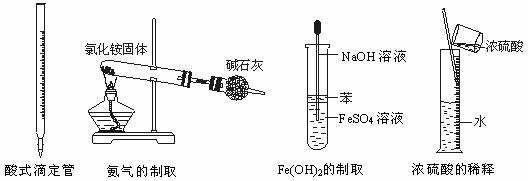
A B C D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com