
题目列表(包括答案和解析)
24.答案:(1)氧化铝 Al(OH)3
(2)铝热 加少量KClO3,插上Mg条并将其点燃
(3)4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3
(4)Al2O3 + 2OH-+ 3H2O=2[Al(OH)4]-
(5)Al3++ 3H2O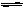 Al(OH)3(胶体)+ 3H+
Al(OH)3(胶体)+ 3H+
解析:本题是一道典型的无机框图推断题。不仅考查对元素化合物基础知识的掌握,还主要考查学科内知识间的综合推理能力。由D是一种红棕色固体可知D为Fe2O3,则J:Fe(OH)3,G:Fe(OH)2,F:FeCl2,E:Fe,结合框图信息和已知条件,其它物质分别为:A:Al2O3。B:O2,C:Al,H:Na[Al(OH)4],I:AlCl3。知道了每种物质,问题即可做答。
24.(10分)A-J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。

请回答下列问题:
(1)A物质的名称为___________,H与I反应所得难溶物化学式为 。
(2)C与D在高温下的反应在冶金工业上称为 反应,引发该反应的实验操作是__________ ______。
(3)G→J的化学方程式为_________________ __________ _____。
(4)A→H的离子方程式为_________ ____ _______。
(5)用离子方程式表示I物质能用于净水的原理_________ _______。
23.答案:(1)0.03
(2)①0.5 大于 该反应正反应为放热反应,化学平衡常数随温度的升高而减小
② 向左 b
(3)小于
解析:(1)0-4min CO的平均反应速率为:
v(CO)=(0.20-0.08) mol·L-1/4 min=0.03 mol·L-1·min-1
(2)t1℃时3min-4min为平衡状态,该反应的平衡常数为:
K(t1℃)={[CO2]·[H2]}/{[CO]·[H2O]}=(0.100×0.100)/( 0.100×0.200)=0.5
由左图知:850℃时,CO、H2O、CO2、H2的平衡浓度分别为:0.08 mol·L-1、0.18 mol·L-1=0.12 mol·L-1、(0.20-0.08) mol·L-1=0.12 mol·L-1、0.12 mol·L-1,平衡常数为K(850℃)= (0.12×0.12)/( 0.18×0.08)=1。K(t1℃)<K(850℃),故t1℃大于850℃,因为该反应正反应为放热反应,化学平衡常数随温度的升高而减小。
由右上表知:反应在4min-5min间,CO(g)和H2O(g)的浓度增大,CO2的浓度减小,只能是增加了H2的浓度,平衡向左移动。
(3)850℃时,CO2(g)十H2
(g)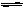 CO(g)十H2O(g)与原反应互为可逆反应,其平衡常数为K(850℃)也为1。t2℃时,由[CO2]·[H2]=2[CO]·[H2O]得,该温度下的平衡常数为:K(t2℃)={[CO]·[H2O]}/{[CO2]·[H2]}=1/2<1,故t2℃<850℃。
CO(g)十H2O(g)与原反应互为可逆反应,其平衡常数为K(850℃)也为1。t2℃时,由[CO2]·[H2]=2[CO]·[H2O]得,该温度下的平衡常数为:K(t2℃)={[CO]·[H2O]}/{[CO2]·[H2]}=1/2<1,故t2℃<850℃。
23.(10分)一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如下反应:CO(g)十H2O(g)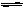 CO2(g)十H2 (g);△H<0
CO2(g)十H2 (g);△H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0-4min的平均反应速率v(CO)=_ _mol·L-1·min-1
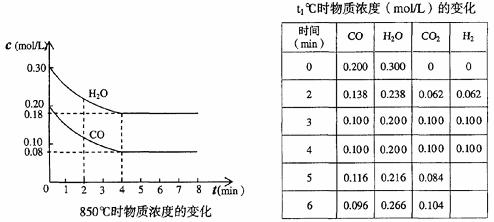
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。
①计算t1℃该反应的平衡常数为 ,t1℃ 850℃(填大于、小于或等于)。判断依据是________ _______。
②t1℃时,反应在4min-5min间,平衡 移动(填“向左”、“向右”或“不移动”),可能的原因是________。
a.增加CO的浓度 b.增加H2的浓度
c.加压 d.使用催化剂
(3)t2℃时,反应CO2(g)十H2 (g) CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃
850℃(填大于、小于或等于)。
CO(g)十H2O(g)的平衡浓度符合[CO2]·[H2]=2[CO]·[H2O],则t2℃
850℃(填大于、小于或等于)。
22.答案:(1)①碳酸氢钠放出气泡快
②碳酸氢钠、53:42
③不正确
(2)①关于碳酸氢钠与碳酸钠与盐酸反应热效应的研究
②温度计、托盘天平
吸热 放热 吸热、放热 a、c
解析:(1)NaHCO3和Na2CO3与稀盐酸的反应,前者反应速率块,故反应开始时,盛碳酸氢钠的试管中放出气泡快,产生的CO2气体多,气球体积先变大。由关系式NaHCO3-HCl-CO2,Na2CO3-2HCl-CO2可知,NaHCO3、Na2CO3分别与3mL4mol·L-1盐酸完全反应时,需二者的质量分别为:1.008g、0.636g,故均为0.3 g 的NaHCO3、Na2CO3不足,二者全反应掉。产生CO2的体积比约为(0.3/84):(0.3/106)=53:42。
同学仅通过感官的冷、热得出“不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应”的结论是不正确的。因为NaHCO3、Na2CO3固体与稀盐酸反应的反应热是通过NaHCO3、Na2CO3固体溶解的热效应和其饱和溶液与盐酸反的应热效应之和来计算的。
(2)该实验是研究物质反应的热量变化的,所以该研究报告的题目是《关于碳酸氢钠与碳酸钠与盐酸反应热效应的研究》。该实验中所用的仪器有试管、药匙、气球、玻璃棒、烧杯、量筒、保温瓶、温度计、托盘天平等。通过分析上述表中的数据,知:NaHCO3的溶解是吸热过程;Na2CO3的溶解是放热过程;NaHCO3的饱和溶液和盐酸的反应是吸热反应;Na2CO3的饱和溶液和盐酸的反应是放热反应。NaHCO3固体与稀盐酸反应的反应热是NaHCO3的溶解和NaHCO3的饱与溶液和盐酸的反应二者的热效应之和。
22.(13分)(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL、4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
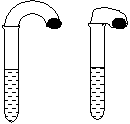 ①试管中(填产生沉淀或气体及反应速率等相关现象)
①试管中(填产生沉淀或气体及反应速率等相关现象)
________________________ _。
②盛______________的试管中气球变得更大,大小气球(包含试管)体积之比约为(填最简单整数比)____________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g); △H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g); △H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
35mL水 |
2.5g
NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2g Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《________________________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论:
a:NaHCO3的溶解是_______(“吸热”或“放热”)过程;
b:Na2CO3的溶解是_______(“吸热”或“放热”)过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________(“吸热”或“放热”)反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________(“吸热”或“放热”反应;
e:NaHCO3固体与稀盐酸反应的反应热是______(填a→d的字母)的热效应之和。
21.答案:ABE Na2ZnO2、Na2C2O4、 NaOOCCH2COONa等从中任选1个或其它合理答案均可得分。
解析:本题为开放性探究试题。向该溶液中,滴入稀盐酸,产生使澄清的石灰水变浑浊的无色气体,则原溶液可能是Na2CO3,也可能是Na2SO3,故C错误;向该溶液中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀溶解,则原溶液不是Na2SiO3溶液,因为白色胶状沉淀硅酸不溶于盐酸,所以D错误。从标签破损处,可猜测该试剂还可能是Na2ZnO2、Na2C2O4或 NaOOCCH2COONa等。
21.(5分)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如右图。某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为完全正确(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项 (多选倒扣分)。
|
序号 |
猜想物质的化学式 |
检验需要的试剂 |
操作、现象及结论 |
|
A |
Na2SO4 |
稀盐酸、 氯化钡溶液 |
取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4。 |
|
B |
Na2CO3 |
稀盐酸、澄清的石灰水、品红溶液 |
取少量该溶液于试管中,滴入稀盐酸,如果产生的气体不能使品红溶液褪色而能使澄清的石灰水变浑浊,则原溶液是 Na2CO3。 |
|
C |
Na2SO3 |
稀盐酸、 澄清的石灰水 |
取少量该溶液于试管中,滴入稀盐酸,如果产生无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2SO3。 |
|
D |
Na2SiO3 |
过量稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀溶解,则原溶液是Na2SiO3溶液。 |
|
E |
Na2S2O3 |
稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,如果溶液变浑浊(或产生淡黄色沉淀),并产生无色有刺激性气味的气体,则原溶液是Na2S2O3溶液。 |
除上述五种可能之外,写出你认为还有可能物质的化学式(1种): 。
20.答案:B
解析:若铝对于硫酸和氢氧化钠均不足,生成氢气的物质的量之比应为1∶1,此与事实不符;若铝对于硫酸和氢氧化钠均过量,生成氢气的物质的量之比应为2∶3,此与事实也不符;若铝对氢氧化钠于不足,对于硫酸过量,生成氢气的物质的量应介于1∶1与2∶3之间,此与事实相符。B正确。
第II卷(非选择题,共90分)
必做题部分(本部分包括6小题,共60分)
20.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两个烧杯中,各加等物质的量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量
D.甲中酸过量、乙中碱过量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com