
题目列表(包括答案和解析)
29.(物质结构与性质模块10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol-1):
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子空间构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填“名称”);晶体ZW的熔点比晶体XW4明显高的原因是 。
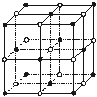
(4)ZW晶体的结构示意图如下。已知:ρ(ZW)=2.2 g·cm-3,NA=6.02×1023 mol-1,则ZW晶体中两个最近的Z离子中心间的距离为 。
28.答案:(1)D;(2)B,D。
(3)①联合制碱法或侯德榜制碱法 化肥或电解液或焊药等
②NH3+CO2+H2O+NaCl→NH4Cl+NaHCO3↓
或NH3+CO2+H2O→NH4HCO3, NH4HCO3+NaCl→NaHCO3↓+NH4Cl
③CO2
④I; 过滤
⑤ NaCl、NH4Cl、NH4HCO3 a、c
解析:(1)由信息知:杜绝污染源符合“绿色化学”观念。
(2)化工厂应建在水资源丰富和交通方便的远离城市的郊区,不宜建在人口稠密的居民区。
(3)侯德榜制碱法的原理是利用一定条件下NaHCO3溶解度相对较小的特点,在饱和食盐水中先后通入NH3、CO2,获得NaHCO3后再煅烧生成Na2CO3。
①上述生产纯碱的方法称联合制碱法或侯德榜制碱法,其副产品NH4Cl可做化肥或电解液或焊药等
②沉淀池中发生的反应是:
NH3+CO2+H2O→NH4HCO3,NH4HCO3+NaCl→NaHCO3↓+NH4Cl
③上述流程中煅烧炉内的NaHCO3分解产生的CO2可循环使用,故X物质是CO2。
④母液中含有氯化钠通过I循环使用,提高氯化钠的利用率;从沉淀池中得到NaHCO3沉淀需过滤。
⑤ NaHCO3大部分析出后,母液中仍溶有部分Na+、HCO3-、NH4+和Cl-,向母液中通氨气时发生反应HCO3-+NH3→NH4++CO32-,增大了NH4+的浓度,使NaHCO3转化为Na2CO3,NH4Cl更多地析出,也提高了其纯度。
28.(化学与技术模块10分)早在20世纪90年代,国际上提出了“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节能都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是 。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为可行的是 。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便的远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
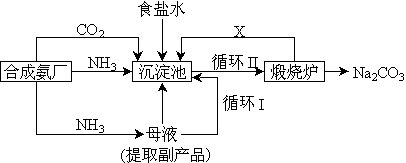
①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
⑤母液中含有 ,(以化学式表示)。有向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
27.(1)I2 ;不是;碘易升华
(2)①C
②碘在水中的溶解度小而在四氯化碳中的溶解度大且四氯化碳与水互不相溶。

(3)把华素片在水中研碎后,滴入淀粉溶液,若显蓝色,可验证华素片中含有碘分子
(4)用淀粉验证更合适
解析:(1)由信息知华素片中含碘单质(紫黑色),显然它不是白色的。由于碘易升华,故在遮光、密闭、凉处保存。
(2)由于碘在水中的溶解度小而在四氯化碳中的溶解度大且四氯化碳与水互不相溶,故四氯化碳可把碘萃取,从而在下层(四氯化碳)观察到紫色。由于酒精、甘油与水混溶,故无法萃取碘单质,而热裂汽油中含有不饱和烃,与碘发生加成反应,故不能选酒精、甘油、热裂汽油做萃取剂。
(3)由于碘与淀粉发生显色反应(蓝色),故把华素片在水中研碎后,滴入淀粉溶液,若显蓝色,可验证华素片中含有碘分子。
(4)在家庭小实验中要验证华素片的活性成分,其试剂显然是淀粉更方便,故此法更适合于家庭小实验。
27.(化学与生活模块10分)下面是关于药物华素片(西地碘片)使用说明中的部分内容:
|
华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等。 [贮藏]遮光、密闭、在凉处保存。 [有效期]二年 |
(1)请根据这段文字判断,华素片中含有的活性成分是 (写分子式);请推断该华素片 (“是”或“不是”)白色。说出说明书中的贮藏注意点的主要原因是 。
(2)某同学欲证实华素片中确实含有上述成分,设计并完成了如下实验,请填空:
①将该药片放入研钵中研碎后,装入小试管中并加入约2 mL蒸馏水,再加入约2 mL
(填选项字母)后用力振荡;
A.酒精 B.热裂汽油 C.四氯化碳 D.甘油
②选用该液体做实验的理由是 。
在下图中标出试管中加入该液体后可能所观察到的液体颜色(只选填其中一空)。

(3)请再设计另一种方法验证华素片中的成分(注意叙述操作方法、实验现象和实验结论) 。
(4)比较上述两种验证华素片中的成分的方法哪一种更适合于家庭小实验 。
0.010L×6mol·L-1-0.01 mol=0.05mol,则硝酸铜的物质的量为:
1/2×0.05mol=0.025mol
(3)根据铜元素守恒和电子守恒得:
n(Cu)+ n(CuO) + 2n(Cu2O)=0.025 mol (铜元素守恒)…①
2n(Cu)+2n(Cu2O)=3n(NO) (电子守恒) …②
联立①、②两式,代入数据解得n(Cu2O)=n(CuO)=0.005 mol
(4)由②式得n(Cu)< 3/2n(NO)=0.015;
②式-①式得n(Cu)-n(CuO)=3n(NO)-0.025=0.005
n(Cu)> 0.005
故0.005< n(Cu)< 0.015
选做题部分(本部分包括4小题,共30分。考生可从中选做3个题目,多选多做不计分)
0.224L/22.4L·mol-1=0.01 mol,溶液中NO3-的物质的量为:
26.答案:(1)Cu2O+HNO3→Cu(NO3)2+NO↑+H2O
(2)0.025
(3)0.005 0.005
(4)0.005<x<0.015
解析:(1)Cu2O跟稀硝酸反应的化学反应方程式为:
Cu2O+HNO3→Cu(NO3)2+NO↑+H2O
(2)发生氧化还原反应当硝酸的物质的量与NO的物质的量相等,即:
26.(10分)铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入10mL 6mol·L-1HNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式__________ __ 。(不必配平)
(2)产物中硝酸铜的物质的量______________mol;
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol
(4)如混合物中Cu的物质的量为x,求x的取值范围________________。
25.(12分)发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度________________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H5++H2O N2H4+H2O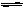 N2H5++OH-
N2H5++OH-
N2H5++H2O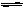 N2H62++OH- N2H5++ H2O
N2H62++OH- N2H5++ H2O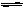 N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)发射火箭时肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知3.2gN2H4(l)在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式
________ 。
因此肼可以作为火箭推进剂。根据该反应,你认为是否可以通过改变反应条件,由N2和水来制取N2H4,若能,指出可能的反应条件;若不能,请指出原因。
。
25答案:(1)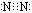
(2)2NH3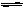 NH4++NH2-
NH4++NH2-
(3)大于;[NO3-]>[NH4+]>[Na+]>[OH-] >[H+]
(4)C
(5)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-642.2 kJ·mol-1,
不能;由于该反应放出大量的热,其逆反应需要吸收大量的热,即逆反应的△H是很大的正值,且由N2和水蒸气生成肼和双氧水是熵减小的,因此反应:N2(g)+4H2O(g)=N2H4(l)+2H2O2(l)的△H-T△S总是大于零,说明该反应不能自发进行,故不能用N2和水来制取N2H4。
解析:(1)N2的电子式为: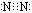
(2)由于液态NH3类似H2O,故可由水的电离:2H2O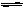 H3O++OH-写出液态NH3电离方程式:2NH3
H3O++OH-写出液态NH3电离方程式:2NH3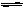 NH4++NH2-。
NH4++NH2-。
(3)NH4+水解,促进水的电离,NaOH溶液中OH-抑制水的电离,故:0.1mol·L-1 NH4NO3溶液中水的电离程度大于0.1mol·L-lNaOH溶液中水的电离程度。将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合后得等物质的量NH4NO3、NaNO3和NH3·H2O,所得溶液中离子浓度由大到小的顺序为[NO3-]>[NH4+]>[Na+]>[OH-] >[H+]。
(4)由信息知肼水解显弱性,肼在水中电离出OH-离子,且为肼是二元弱碱。
(5)3.2gN2H4(l)为0.1 mol,在上述反应中放出64.22kJ的热量,该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-642.2 kJ·mol-1。
不能通过改变反应条件由N2和水来制取N2H4,原因是:由于该反应放出大量的热,其逆反应需要吸收大量的热,即逆反应的△H是很大的正值,且由N2和水蒸气生成肼和双氧水是熵减小的,因此反应:N2(g)+4H2O(g)=N2H4(l)+2H2O2(l)的△H-T△S总是大于零,说明该反应不能自发进行,故不能用N2和水来制取N2H4。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com