
题目列表(包括答案和解析)
10.在m mL b mol·L-1 AlCl3溶液中,加入等体积a mol·L-1的NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是________mol。
(2)当a、b满足________条件时,无沉淀生成。
(3)当a、b分别满足______________条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________。
9.答案:(1)逆 D的浓度增大倍数(2.4倍)小于压强增大倍数(2.5倍)
(2)正 D的浓度增大倍数(2.2倍)大于压强增大倍数(2倍) 在该温度下,压强大于1×106 Pa时,A物质仍为气态,而D与E物质至少有一种变成了液态
解析:分析表中数据,当D的浓度增大2.4倍时,压强增大倍数为2.5倍,可推知平衡随压强增大向逆反应方向移动,即a<d+e;当压强进一步增大时,分析数据可知D、E中至少有一种变成了液态。
9.在10
℃和2×105 Pa的条件下,反应aA(g) 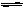 dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出了不同压强下反应建立平衡时物质D的浓度。
|
压强/Pa |
2×105 |
5×105 |
1×106 |
|
D的浓度/mol·L-1 |
0.085 |
0.20 |
0.44 |
根据表中数据,回答下列问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡向_________(填“正”“逆”)反应方向移动,理由是_______________________________。
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向_______(填“正”“逆”)反应方向移动,理由是______。平衡之所以向该反应方向移动,是由于__________________。
8.答案:(1)A、B各属于NaCl、HCl中的某种物质,C、D各属于NaOH、酚酞中的某种物质
(2)A为HCl,B是NaCl
(3)C是NaOH,D是酚酞
解析:(1)两两反应的预期现象如下表所示,与A、B、C、D两两反应的现象表对照,可推断出:A、B各属于NaCl、HCl中的某种物质,C、D各属于NaOH、酚酞中的某种物质。
|
|
NaOH |
NaCl |
HCl |
酚酞 |
|
NaOH |
|
- |
- |
溶液变红 |
|
NaCl |
- |
|
- |
- |
|
HCl |
- |
- |
|
- |
|
酚酞 |
溶液变红 |
- |
- |
|
(2)红色溶液中含有NaOH和酚酞,加入NaCl时,预期出现的现象是红色溶液的颜色不发生变化;加入HCl时,预期出现的现象是红色溶液的颜色褪去。B滴入红色溶液中出现的现象与NaCl滴入红色溶液中预期出现的现象一致,A滴入红色溶液中出现的现象与HCl滴入红色溶液中预期出现的现象一致,可推断出:A为HCl,B是NaCl。
(3)取A(HCl)溶液2 mL,若滴入3滴NaOH和4 mL酚酞,预期出现的现象是溶液的颜色无明显变化,若滴入3滴酚酞和4 mL NaOH,预期出现的现象是溶液的颜色由无色变成红色。滴入3滴C溶液和4 mL D溶液时,出现的现象与滴入3滴NaOH和4 mL酚酞时预期出现的现象一致。可推断出:C是NaOH,D是酚酞。
8.一位同学配制的如下四瓶溶液忘记了贴标签:NaCl(0.1 mol·L-1)、HCl(0.1 mol·L-1)、NaOH(0.1 mol·L-1)、酚酞溶液(0.1%)。这位同学将四瓶溶液编号为A、B、C、D,他不用其他试剂进行鉴别的实验步骤和现象记录如下。请帮助他进行推断。
(1)各取溶液少许两两混合反应,反应现象如表所示:
|
|
A |
B |
C |
D |
|
A |
|
- |
- |
- |
|
B |
- |
|
- |
- |
|
C |
- |
- |
|
溶液变红 |
|
D |
- |
- |
溶液变红 |
|
推断结论:___________________________。
(2)取红色混合溶液少许,不断滴入A溶液,溶液的红色褪去;另取红色混合溶液少许,不断滴入B溶液,溶液颜色无变化。
推断结论:___________________________。
(3)取A溶液2 mL,滴入3滴C溶液,再加入D溶液4 mL,在这个过程中无明显颜色变化。
推断结论:___________________________。
7.答案:(1)乙醇,浓H2SO4
(2)①作催化剂②作吸水剂,有利于反应向生成酯的方向进行。
(3)防止暴沸 中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,便于分层,提纯乙酸乙酯。
(4)小,水果香
(5)①防止倒吸 ②使乙酸乙酯充分冷凝
(6)①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;②乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物;③丙同学加入的碱过量使生成的酯已经水解为可溶性的醇和钠盐。
(7)
解析:向容器中加液体的方法是先加密度小的,再加密度大的。对加热液体易暴沸的应加碎瓷片。制备乙酸乙酯的反应是:
CH3COOH+CH3CH2OH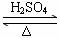 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
该反应中浓硫酸的作用是作催化剂和吸水剂,有利于反应向生成酯的方向进行。饱和碳酸钠溶液的作用是:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,便于分层,以提纯乙酸乙酯,所得乙酸乙酯是不溶于水、密度比水小且有水果香气味的液体。
上述装置中球形干燥管的作用是:防止倒吸,使乙酸乙酯充分冷凝。
甲、乙、丙三位同学的结果不同的原因是:甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;乙同学加入碱量不足,所以蒸馏出来的有过量的酸,得到显酸性的酯的混合物;丙同学加入的碱过量,使生成的酯已经水解为可溶性的醇和钠盐。
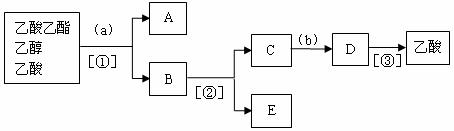
由“分离乙酸乙酯、乙醇、乙酸混合物”的实验流程图知:试剂a是饱和碳酸钠溶液,b是稀硫酸;分离方法①、②、③分别是分液、蒸馏、蒸馏;A、B、C、D、E的名称分别是:乙酸乙酯、乙醇和乙酸钠、乙酸钠、乙酸钠和乙酸、乙醇。
7.某同学用右图所示实验装置制取乙酸乙酯。回答以下问题:

(1)在大试管中先加入3mL ,然后一边摇动一边慢慢地加入2 mL 和2 mL乙酸,混合均匀,然后加入几粒碎瓷片。按上图连好装置,用酒精灯对大试管小心均匀加热,当观察到明显现象时停止实验。
(2)加入浓硫酸的目的是: 。
(3)加热前,大试管中加入几粒碎瓷片的作用是 ,饱和碳酸钠溶液的作用是: 。
(4)乙酸乙酯的密度比水 (填“大”或“小”),有 气味。
(5)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用有:
① ,② 。
(6)有甲、乙、丙三位同学,分别将乙酸与乙醇反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来。但他们的结果却不同:
①甲得到了不溶于水的中性酯;
②乙得到显酸性的酯的混合物;
③丙得到大量水溶性物质。
试分析产生上述各种现象的原因。
(7)下图是某同学探究“分离乙酸乙酯、乙醇、乙酸混合物”实验操作步骤流程图。
请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称。
6.答案:(1)验证Na与CuSO4溶液反应是否有Cu生成
(2)Cu(OH)2可溶于盐酸而Cu不溶
(3)镊子 烧杯 CuSO4溶液 盐酸或稀硫酸 CuO Na与水反应放出的热使生成的Cu(OH)2部分分解
解析:(1)该学生怀疑Na也与CuSO4发生了置换反应而生成了Cu,因而他实验探究的目的是验证Na与CuSO4溶液反应是否有Cu生成。(2)当Na不与CuSO4发生置换反应时,沉淀只含有Cu(OH)2;当Na与CuSO4发生置换反应时,沉淀中既有Cu(OH)2,又有Cu。根据Cu(OH)2可溶于盐酸而Cu不溶,只要是加入过量的盐酸观察沉淀是否全部溶解即可。(3)这个实验需要首先完成Na和CuSO4溶液的反应,然后再进行沉淀与盐酸的反应。完成Na与CuSO4溶液的反应,需要的试剂是Na和CuSO4溶液,还需要的用品是镊子、烧杯。完成沉淀与盐酸的反应,需要的试剂是稀盐酸或稀硫酸,不再需要别的用品。Na与水反应放出大量热量,而Cu(OH)2受热易分解,因此,实验中意外发现的黑色沉淀应该是CuO。
6.在课堂上,老师演示了金属Na与CuSO4溶液反应的实验,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现Cu单质生成。但某同学心中在想,会不会是因为生成的Cu较少而被蓝色沉淀所覆盖从而没有被发现呢?于是想课后到实验室继续研究,希望进一步用实验来验证自己的猜想是否正确。
假如该同学是你,请你写一份实验准备单交给老师,要求老师提供必需的用品。
(1)实验探究的目的:_____________________________。
(2)探究所依据的化学原理:_____________________________。
(3)实验必需的用品:小刀、玻璃片、滤纸、_____________和_____________;金属Na、_____________和_____________。
该同学在探究实验中意外地发现生成的蓝色的沉淀中混有少量的黑色沉淀,而所使用的药品均没有问题。你认为该黑色难溶物是_____________,生成该黑色难溶物的原因是___________________________________。
5.答案:D
解析:温度由25℃升高到50℃时,固体的质量没有变化,说明在25℃-50℃时MnC2O4·2H2O未发生变化,A说法正确;温度升高到75℃时,固体的质量发生了变化,
MnC2O4·2H2O可能是按如下化学方程式反应的:MnC2O4·2H2O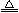 MnC2O4+2H2O↑,据此可算出17.9 g MnC2O4·2H2O完全分解应得到残渣14.3 g,与表中实验数据正好相符,说明上述假设成立,进而可判断B、C两说法正确,D说法错误。
MnC2O4+2H2O↑,据此可算出17.9 g MnC2O4·2H2O完全分解应得到残渣14.3 g,与表中实验数据正好相符,说明上述假设成立,进而可判断B、C两说法正确,D说法错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com