
题目列表(包括答案和解析)
14、用惰性电极电解硫酸铜和盐酸的混合溶液,则阴、阳两极产生的气体成分及体积比不可能是
A、阳极为纯净气体,阴、阳两极产生的气体的体积比≤1:1
B、阳极为纯净气体,阴、阳两极产生的气体的体积比≥1:1
C、阳极为混合气体,阴、阳两极产生的气体的体积比≤1:1
D、阳极为混合气体,阴、阳两极产生的气体的体积比≥1:1
13、下列离子方程式正确的是
A.Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.3 mol的Cl2 通入含2 mol FeI2的溶液中: 2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2
C.甲醛溶液中加入足量的银氨溶液并加热
HCHO+ 2[Ag (NH3)2]
++2OH- HCOO-+NH4++2Ag↓+3NH3+H2O
HCOO-+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入少量的CO2 :2C6H5O-+CO2+H2O→2C6H5OH+CO32-
12、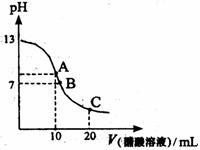 25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是:( )
25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是:( )
A.在A点:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
B.在A点:c(Na+)+ c(H+)==c(OH-)+c(CH3COO-)
C.在B点:c(CH3COO-)> c(Na+)> c(H+)= c(OH-)
D.在C点:c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
11、将16 g FeS与FeO的混合物,投入到含有1 mol的硝酸溶液中充分反应,只产生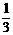 mol NO气体,得到澄清的混合溶液,下列计算结果正确的是
mol NO气体,得到澄清的混合溶液,下列计算结果正确的是
A.混合物中含有0.1 mol FeS B.混合物中含有8 g FeO
C.被还原的HNO3 为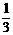 mol
D.参加反应的HNO3
为1 mol
mol
D.参加反应的HNO3
为1 mol
10、关于下列各装置图的叙述中,错误的是
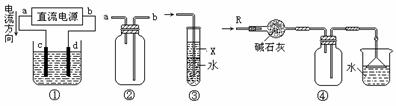
A.装置①中,c为阳极,d为阴极
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
9、金属离子和硫离子在水溶液中的反应比较复杂,其产物与离子的水解、金属硫化物的溶解度、离子氧化性或还原性等因素有关。资料表明,CuS的溶解度很小,在稀酸溶液中也不溶解;Fe2S3的溶解度更小,但却溶于稀酸。下列对有关说法正确的是( )。
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.NH4+和S2-在水溶液中发生相互促进水解,所以不存在(NH4)2S的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物是Fe2+、S和H2S
D.在酸性溶液中,S2-还原Fe3+的能力比还原Cu2+强
8、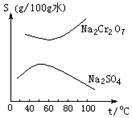 根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得
根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得
到Na2Cr2O7,需要进行三个操作。这三个操作不包括
A. 升温结晶
B. 趁热过滤
C. 降温结晶
D. 蒸发结晶
7、下列各组离子能在指定环境中大量共存的是
A.在c(HCO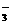 )=0.1mol/L的溶液中:NH
)=0.1mol/L的溶液中:NH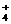 、Al3+、Cl-、NO
、Al3+、Cl-、NO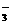
B.在使红色石蕊试纸变蓝的溶液中:SO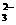 、CO
、CO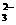 、Na+、K+
、Na+、K+
C.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO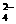
6、将硝酸铵晶体溶于水中,下列变化曲线(其中a代表扩散过程中温度变化情况,b代表水合过程中温度变化情况)中符合实际的是
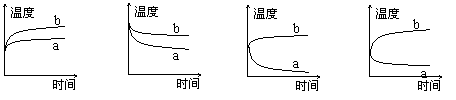
(A) (B) (C) (D)
5、下列有关说法正确的是
A.溴乙烷水解后的碱性溶液不能用硝酸酸化,因为硝酸会把Br-氧化,再加入AgNO3溶液则不会产生浅黄色沉淀
B.为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
C.证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色
D.检验溶液中是否含有SO42-时,在无其它阳离子干扰时,所加的BaCl2溶液用盐酸酸化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com