
题目列表(包括答案和解析)
19、 如图所示,a、b均为石墨电极,c为钛电极,d为碳钢电极,通电进行电解。下列说法正确的是
如图所示,a、b均为石墨电极,c为钛电极,d为碳钢电极,通电进行电解。下列说法正确的是
A.甲、乙两烧杯中溶液的pH均保持不变
B.乙烧杯中d的电极反应为 2Cl––2e–=== Cl2↑
C.乙烧杯中通适量HCl气体后溶液组成可以恢复
D. a极产生1.12L(标况)气体时,c极产生2g气体
18、 某氯化镁溶液的密度为1.2g/cm3,其中氯离子的质量分数为15%,300mL该溶液中Mg2+离子的物质的量约等于
A 0.38mol B 0.63mol C 0.76mol D 1.5mol
17、某可充电的锂离子电池以含锂的过渡金属氧化物(Lin-x MO2)为正极,嵌入锂的碳材料(C6Lin)为负极,含Li+导电固体为电解质。电池放电时的电极反应式为:
负极:C6Lin – xe- === C6Lin-x + xLi+ 正极:Lin-xMO2 + xLi+ + x e-=== LinMO2
下列说法不正确的是
A. 放电时,在电池内部Li+向负极移动
B.充电时,锂离子电池阴极反应为C6Lin-x + xLi+ + x e-=== C6Lin
C.放电时,锂离子电池的电池反应为C6Lin + Lin-xMO2 === LinMO2 + C6Lin-x
D.电池反应中,锂、锌、铅各失去1mol电子,金属锂所消耗的质量最小
16、下列叙述正确的是( )
A.同一周期的元素,原子半径越大,其单质的熔点一定越低
B.第110的元素的电子层数为7,是超铀元素
C.同一主族的元素,其氢化物的沸点逐渐升高
D.同一主族的元素,半径越小越容易失去电子
15、元素周期表中的短周期元素X和Y,可组成化合物XY3,下列说法正确的是
A.XY3一定是离子化合物
B.X和Y一定不属于同一主族,但可属同一周期,
C.若Y的原子序数为m,则X的原子序数一定为m±4
D.X和Y属于同一主族时,单质及XY3在固态时属于同一晶体类型
14、下列实验不能达到预期目的的是
A. Cl2、Br2分别与H2反应,比较Cl2、Br2的非金属性强弱
B. Cl2、S分别与Fe反应,比较Cl2、S的氧化性强弱
C. 测相同浓度Na2CO3、Na2SO4溶液的pH,比较碳酸、硫酸的稳定性强弱
D. 测定相同条件下的盐酸、醋酸溶液的导电性,比较盐酸、醋酸的酸性强弱
13、对于0.1 mol / L的醋酸溶液,下列说法正确的是
A. 加水稀释后,溶液中和c(OH-)都减少
B. 温度升高后,溶液的pH增大
C. 加入少量Na2CO3固体,醋酸电离平衡向左移动
D. 加水少量冰醋酸后,溶液的c(H+)增大
12、某溶液中含有HCO3-、CO32-、SO32-、Na+、NO3- 五种离子。若向其中加入Na2O2充分反应后(溶液体积变化忽略不计),溶液中离子浓度保持不变的是
A.NO3- B.CO32-、NO3-
C.SO32-、NO3- D.CO32-、NO3-、Na+
11、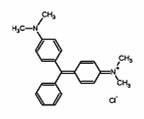 2006年11月17日,上海药监局在市售多宝鱼中检出了硝基呋喃类代谢物和可致癌的孔雀石绿(分子结构如图)等化学物。下列关于孔雀石绿的叙述不正确的是
2006年11月17日,上海药监局在市售多宝鱼中检出了硝基呋喃类代谢物和可致癌的孔雀石绿(分子结构如图)等化学物。下列关于孔雀石绿的叙述不正确的是
A.化学式为C23H25N2Cl B.遇FeCl3溶液呈紫色
C.能发生取代反应 D.属于芳香族的衍生物
10、已知燃烧agCH4气体时生成二氧化碳气体9g液态水,并放出热量222.5kJ。下列热化学方程式正确的是
A.CH4+2O2 === CO2+2H2O;△H = -445 kJ·mol-1
B.CH4(g) +2O2(g) === CO2(g) +2H2O(l);△H = -222.5 kJ·mol-1
|
D.CH4(g) +2O2(g) === CO2(g) +2H2O(g);△H = -890 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com