
题目列表(包括答案和解析)
6.实验探究题(18分)
Ⅰ.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题: 、
、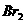 谁的氧化性更强?
谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性: >
>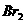 ,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
②乙同学认为氧化性: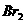 >
>  ,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为_▲_。
②在100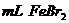 溶液中通入
溶液中通入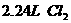 (标准状况),溶液中有1/3的Br-被氧化成单质
(标准状况),溶液中有1/3的Br-被氧化成单质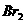 ,则原
,则原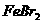 溶液中
溶液中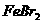 的物质的量浓度为_▲_。
的物质的量浓度为_▲_。
Ⅱ.某校化学实验兴趣小组为“证明某水煤气中CO2、CO 、H2 H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其它杂质气体对本实验无干
 扰)
扰)
(1)该小组证明CO2存在应选用_▲_装置,现象是:_▲_。 证明H2O气的存在应选用_▲_装置,现象是:_▲_。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是: 混合气体-( )-( )-( B )-( )-( )-( )
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?_▲_。
5.(8分)工业“从海水中提取镁”的流程图如下:

其步骤为:
① 将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
② 将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③ 在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④ 将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤ 电解熔融的氯化镁可得到Mg。
请回答以下问题:
⑴步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、铁架台等。
⑵步骤④中的“一定条件”指的是 ,目的是 。
⑶上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
。
⑷有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是 。理由是
。
4、 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如右图。该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如右图。该实验的主要操作步骤如下:
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③用精确的天平分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
。
⑵本实验中应选用 (填序号)的量筒。 A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
3.(9分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
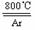 TiO2 +2C+2Cl2
TiO2 +2C+2Cl2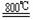 TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:

①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中反应的离子方程式为__________________________________ 。
⑶ 装置D中冷凝管进水口的位置是(填a或b)___ 。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为__ 。
1.(13分)甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
[测定原理]KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O
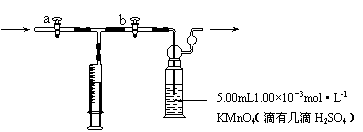 [测定装置]部分装置如下图所示
[测定装置]部分装置如下图所示
[测定步骤]
①用 量取5.00mL 1.00×10-3mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
③打开 ,关闭 (填“a”或“b”),用注射器抽取100mL新装修的房屋室内空气。关闭 ,打开 (填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次所取的高锰酸钾溶液均为5.00mL)。3次实验所消耗草酸溶液的体积平均值为12.38mL。
[交流讨论]⑴计算该居室内空气中甲醛的浓度 mg·m-3,该居室的甲醛 (填是或否)超标。
⑵某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及滴定实验均无错误)提出合理假设:____________________________________ _(至少答出2种可能性)。
⑶实验结束后,该小组成员在相互交流的过程中一致认为:
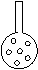 ①实验装置应加以改进。
①实验装置应加以改进。
有同学提议:可将插入KMnO4溶液的管子下端改成具有多孔的球泡(右图),
有利于提高实验的准确度,其理由是______ __
。
②实验原理可以简化。实验中无需用草酸标准液滴定,可直接抽取室内空气,再压送到洗气瓶中至KMnO4溶
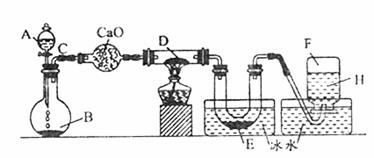 2.(8分)某一化学反应的实验装置如图所示:
2.(8分)某一化学反应的实验装置如图所示:
A-H属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、氯化钙、氧化钙、四氧化三铁、氧化铜、氢气、二氧化碳、二氧化氮、氯气、氯化氢、氨气、氮气、氧气。
实验现象:①D物质由黑色变为红色;②无水硫酸铜粉末放入无色透明的E中得到蓝色深夜;③点燃的镁条伸入无色无味的F中,镁条继续燃烧,将生成的物质放入水中,有气体放出,并有白色浑浊物形成,该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝。通过分析回答:
|
A ;B ;D ;E ;F 。
(2)写出有关的化学方程式:A与B ;C与D ;F与Mg的反应产物与水 。
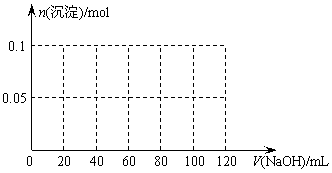
25、(10分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是____________和____________,阴离子是_____________。
(2)试通过计算确定该结晶水合物的化学式。
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol/L,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
24、(8分)将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868g/cm3氨水。
(1)求所得氨水的物质的量浓度?
(2)取上述氨水30.0mL与70.0ml 2.00mol/L的AlCl3溶液相混合,产生的白色沉淀的质量是多少?
(3)往上述反应后未过滤的溶液中加入一定体积的5mol/L的NaOH溶液后,混合后体系中沉淀的质量与上述(2)中产生的沉淀质量相等,求加入的NaOH溶液的体积是多少?
23、(10分)有机物A、B、C、D、E、F、G的相互转化关系如图所示。5.2g F能与100mL1mol/LNaOH溶液恰好完全中和,0.1mol F还能与足量金属钠反应,在标准状况下放出2.24L H2。D的分子式为C3H3O2Na,能使溴水褪色,E的分子中含有羧基。试回答:
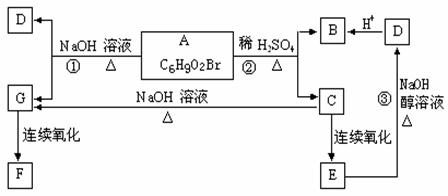
(1)写出下列物质的结构简式:
F D
(2)写出下列反应的反应类型:
反应② 反应③
(3)写出下列反应的化学方程式:
B与溴水反应:
反应①:
22、(8分)有机物A与CH3COOH无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答下列问题。
(1)符合条件的相对分子质量最小的有机物A是 (写结构简式);
(2)若A与乙酸相对分子质量相等,则A的结构简式可以是 ;
(3)若A中C、H元素质量分数之和为86.67%,其余为O,A的分子量小于200,则A的分子式为
。如果A中含苯环结构且能发生银镜反应,符合条件的A的同分异构体有
(写两个即可)。
21、(14分)硼酸晶体呈片状,有滑腻感,可作润滑剂,硼酸对人体的受伤组织有缓和以及防腐作用,故可以用于医药和食品防腐等方面。试回答下列问题:
(1)从题目信息可知硼酸应属于 酸(弱、强、中强);
(2)硼酸的分子式为H3BO3,已知H与O成键,则其分子结构式为: 。
(3)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外层具有达到8电子稳定结构的趋向。已知0.01mol硼酸可以被20mL 0.5mol/LNaOH溶液恰好完全中和,据此推测硼酸在水溶液中呈酸性的原因是(用离子方程式表示) 。
写出硼酸与NaOH溶液反应的化学方程式: 。
(4)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸酯,试写出硼酸完全酯化的方程式:
;
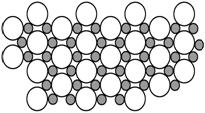 (5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为 ;
(5)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据右图确定硼化镁的化学式为 ;
(6)硼烷(B2H6)气体在空气中能剧烈燃烧生成固态氧化物,已知每生成1mol液态水可放出722kJ的热量,请写热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com