
题目列表(包括答案和解析)
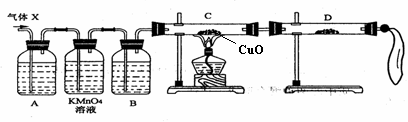
16.(11分)研究性学习小组进行CH4的制备及性质探究实验。
(1)根据反应:CH3COONa(固体)+NaOH(固体)--> Na2CO3+CH4↑制备气体。在答题卷的方框中画出制备CH4的实验装置(含试剂)示意图(固定装置不用画)。
(2)用CH4气体分别进行下列实验:
①通入酸性KMnO4溶液,现象是 。
②在无色玻璃集气瓶中与C12混合后光照,现象是 。
 (3)为了验证CH4是否具有还原性,某小组设计了如下实验:
(3)为了验证CH4是否具有还原性,某小组设计了如下实验:
①当玻璃管中的氧化铜由黑色变为红色时,说明CH4具有还原性。你认为这一结论是否正确? (填“正确”或“不正确”),理由是 。
②实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰出现浑浊现象,则CH4与CuO反应的化学方程式为 。
(4)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是
。请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)。
15.(16分)某化学研究性学习小组计论Fe3+和SO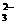 之间发生怎样的反应。可能发生的反应有:2Fe3++SO
之间发生怎样的反应。可能发生的反应有:2Fe3++SO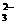 +H2O=2Fe2++SO
+H2O=2Fe2++SO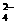 +2H+(氧化还原反应)
+2H+(氧化还原反应)
2Fe3++3SO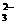 +6H2O=2Fe(OH)3(胶体)+3H2SO4(水解反应)
+6H2O=2Fe(OH)3(胶体)+3H2SO4(水解反应)
为了证明反应的实际情况,同学们设计并实施了下列实验,请填写下列空白:
实验I:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是
。
实验II:①取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是
。将溶液分成两等份,其中一份加入KSCN稀溶液,溶液变成血红色,反应的离子方程式为 。
另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
②换用稀释的FeCl3和Na2CO3溶液重复实验II。实验II、III产生的现象完全相同。由上述实验得出的结论是 。
实验III:若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。
从形式上看,Na2CO3和Na2SO3相似。但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① 。
②
14.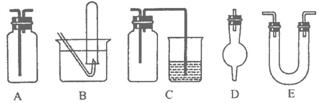 (14分)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。
(14分)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。
请回答下列问题:
(1)能用作干燥氨气的装置有_________(填字母);
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有_________(填字母);
(3)在氯气和铁反应实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有_________(填字母);
(4)能用于乙烯与溴水反应制二溴乙烷的实验装置有_________(填字母);
(5)若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是_____________________________________________。
13.试回答下列问题:
(1)下列实验中所选用的仪器或操作以及结论不合理的是___ _。
A.用托盘天平称量11.7g 氯化钠晶体
B.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上与标准比色卡比较
E.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH3COOH溶液
F.用锌和稀硫酸制H2时,为了使制取H2的速率加快,可以向稀硫酸溶液中加入少量CuSO4溶液
G.用碱式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液;
H.不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
I.用瓷坩埚高温熔融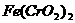 和
和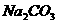 固体混合物;
固体混合物;
J.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备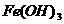 胶体;
胶体;
K.配制 饱和溶液时,加入少量的稀硫酸.
饱和溶液时,加入少量的稀硫酸.
(2)欲量取20.00mL Na2CO3溶液,应选用的仪器是 。
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(4)在硫酸铜晶体中结晶水含量的测定实验中,称量操作至少要进行 次。
 (5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
①可通过观察 来定性比较得出结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进? 。
12.
 (12分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
(12分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度分别为:
氯化铵:10℃时33.3 g、20℃时37.2 g、30℃时41.4g;氟化钠:20℃时4 g;氟硅酸钠微溶于水。
请回答下列问题:
⑴ 上述流程中发生两步化学反应,第一步反应的化学方程式为: ,
第二步反应能进行是因为 。
⑵ 操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
⑶ 操作II的作用是 。
⑷ 操作Ⅲ的具体过程是 。
⑸ 流程中NH4HCO3必须过量,其原因是 。
11. (10分)某兴趣小组同学共同设计了如图所示的实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
(10分)某兴趣小组同学共同设计了如图所示的实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
⑴ 打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,但装置II只能收集H2、NH3,不能收集O2。其理由是 。
乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。你认为他的改进方法是 。
⑵ 打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是 ;仪器D在该装置中的作用是 。
丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是 。
10.(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金
属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。
(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
|
氢氧化物 |
Fe(OH)3 |
A1(OH)3 |
|
开始沉淀pH |
1.5 |
3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是
,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO2(g)==C(s)+O2(g); △H=393.5 kJ·mol-l
②CO(g)+ O2(g)==CO2(g); △H=-283 kJ·mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H =141 kJ·mol-l
写出TiO2与Cl2+C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
9.(20分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
(1)将仪器连接好以后,必须进行的第一步操作是___________________。
(2)此实验还必须用到的最重要的仪器是__________;仪器F的作用是________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引
起Na2CO3含量的测量结果比实际值偏低,理由是____________________。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液
d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰
h.五氧化二磷 i.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:
B中_____________,D中______________,E中_____________。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是______________。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为____。
8、(16分)某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
 (2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
①组装好仪器后,盛放药品前,必要的一个操作是 。
②A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 ,作用是 。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是 ,D中最好选择的试剂是 。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为 (填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
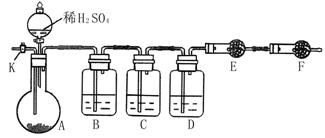
7.(14分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
 (3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高、副产品少、产生的有害废物少、保护环境等是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com