
题目列表(包括答案和解析)
13.(13分)
(1)BD(2分)
(2)碱式滴定管 (1分)
(3)环形玻璃搅拌棒、量筒 (2分)
(4)4(2分)
(5)①反应产生气泡快慢或反应完成的先后或试管壁的冷热程度。(2分)
②控制阴离子相同,排除阴离子的干扰,将FeCl3改为Fe2(SO4)3 。(4分)
12.(1) H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O NaF比NaCl的溶解性小 (2) 烧杯、漏斗 (3) 除去NaF 、NH4Cl 表面的杂质 (4) 加热蒸发溶剂,析出多量固体后冷却 (5) 必须保证H2SiF6能全部反应,防止在进行反应Ⅱ时H2SiF6将与NaCl反应,生成Na2SiF6沉淀,混入NaF中影响NaF质量
(本题共12分,每空2分,其它合理答案参照给分)
11.(1)氧气的密度比空气大(2分) 将装置II中装滿水 (2分) (2)溶液呈橙色等(2分) 防止倒吸 (2分) 比较醋酸、碳酸和苯酚的酸性:CH3COOH >H2CO3>C6H5OH等(2分)
(本题共10分,其它合理答案参照给分)
10.(16分)
(1)Fe(OH)3 1.5≤pH<3.3 H++ OH-=H2O Fe3++3OH-=Fe(OH)3↓
(每空2分,共8分)
(2)向溶液Ⅱ中加人过量氨水;Al3++3NH3·H2O=Al(OH)3↓+3 NH4+ (每空2分,共4分)
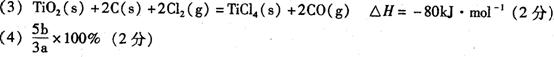
9.(1)检查装置的气密性
(2)托盘天平;防止空气中的水蒸气及二氧化碳等进入E中
(3)检验SO2是否除尽;CO2可溶于水
(4)c; a; g; 使ABCD各仪器中残留的CO2进入E被充分吸收;e或g;偏低
(5)1∶1
8、(本题共16分)
(1)主要杂质气体可能是 H2 (填分子式)。(1分)
产生这种结果的主要原因是(用离子方程式表示)Zn + 2H+ = H2↑+ Zn2+ (2分)
(2)①必要的一个操作是检查装置的气密性(2分)
②A中加入的试剂可能是: 品红试液 (1分),作用是证实SO2的存在(2分)。
B中加入的试剂可能是:浓硫酸(1分),作用是干燥氢气(2分)。
③应观察到C中的实验现象是:固体由黑色变成红色 (2分),D中最好选择的试剂是:固体无水硫酸铜(1分)。
(3)改进时可选用的下列仪器为 a、c、e、g (填代号)。(2分)
7.(14分,每空各2分)
(1)除去混在氢气中的酸性气体
(2)A B、C 将E中的产生的硫酸亚铁溶液压入D中
(3)② (4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化等其它合理答案
3.尾气中可能含CO而没有处理,将尾气通过导管引出用酒精灯火焰将CO烧掉。(2分)
2.混和气体→F-C- B →A→F→C(2分)
6.(18分)
Ⅰ.(共10分)(2)、①Br2 ②Fe3+ (3)、 d 溶液呈血红色, b CCl4层呈无色。(以上每空1分,共6分),(4)、2Fe2++Br2=2Fe3++2Br- (2分) 5、1.2mol/L(2分)Ⅱ.(共8分)1、C,(石灰水)变混浊, F,(无水硫酸铜)由白色变蓝色 (每空1分,共4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com