
题目列表(包括答案和解析)
5.用 25.30mL 98%的浓H2SO4(d=1.84g/cm3)配制20%的H2SO4溶液(d=1.14 g/cm3)200.00 mL,需加水
A.181.55 mL B.174.70 mL C.182 mL D.200 mL
4.下列说法正确的是
A. 赤潮、酸雨、臭氧层空洞、潮汐等都与环境污染有关
B.SiCl4的熔点比SiF4的熔点高,是由于它们的晶体类型不同
C.光导纤维是用晶体硅为主要原料制成的
D.HF的沸点比HCl沸点高,是由于HF分子之间存在氢键
3.下列说法正确的是
A.正四面体型的分子结构中键角均为109°28′ B.在晶体中只要有阳离子就一定有阴离子
C.发生化学反应时失去电子越多的金属原子,还原能力越强
D.两种微粒的质子数和电子数均相等,则它们不可能是带异性电荷的离子
2.关于锂、钠、钾、铷、铯的性质递变规律,不正确的叙述是
A.单质的密度依次增大 B.单质的熔沸点依次降低
C.单质的还原性依次增强 D.离子的氧化性依次减弱
1.下列对生产、生活有关化学问题的分析正确的是
A.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质
B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
C.“百炼成钢”的化学含义是使用氧化剂提高生铁中碳的含量
D.液氯罐中的液氯泄漏时,可将其移入水塘中,并向水塘中加入生石灰
31.某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
[实验Ⅰ]学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是
. 。
[实验Ⅱ]取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 ;向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是
. ;
将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成。产生血红色现象的离子方程式是
. 。
[实验Ⅲ]换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 ;
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是
. 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
30.己知 : 下列各种物质都由短周期元素组成 , 它们之间的关系如下图所示。
常温下 ,A 、 F 为金属单质 , F 既能与 L 溶液反应, 又能与 N 溶液反应。 C、 H 、 M 为气体单质 , 其中 H 呈黄绿色 ,A 、 B 、 I 、 K 、 L 、 R 的焰色反应均呈黄色。请回答 :
(l)P的结构式为 ;B 的电子式为___________________;
(2)R水溶液呈碱性的原因可用离子方程式表示为
_ ;
(3)还有一种物质能与B反应生成C.写出这个反应的化学方程式
_ ;
(4)还有一种物质能与J反应生成C,写出这个反应的化学方程式
_ ;
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用 ,写出发生的离子反应方程式 。
28.己知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复: NH4+ 、Ba2+ 、 Na+ 、H+、SO42-、NO3-、OH-、CO32-,将这4种溶液分别标记为A、B、C、D进行如下实验: ①在A或D中滴入C,均有沉淀生成;② D和B反应生成的气体能被A吸收; ③ A和D反应生成的气体能被B吸收。试回答下列问题 :
(1) D的化学式是 , 判断理由
(2) 写出其余几种物质的化学式 : A B C
(3) 写出实验②中有关反应的离子方程式
 29某共价化合物含 C 、 H 、 N三 元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单 键和 C=C 双键。
29某共价化合物含 C 、 H 、 N三 元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单 键和 C=C 双键。
 (1) 试确定该化合物的分子式_____________(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如右图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为____________________。
(1) 试确定该化合物的分子式_____________(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如右图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为____________________。
27.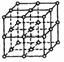 如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有 个。
(2)已知食盐晶体的密度为2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。食盐晶体中两个距离最近的钠离子中心间的距离为 cm。计算过程如下:
26.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X.Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
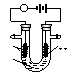 ①电解池中X极上的电极反应式为
。在X极附近观察到的实验现象是
。
①电解池中X极上的电极反应式为
。在X极附近观察到的实验现象是
。
②Y电极上的电极反应式为 。检验该电极反应 产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com