
题目列表(包括答案和解析)
25.(10分)(1)测定铜合金中Cu的含量时,可以用硝酸溶解样品,也可用双氧水和盐酸溶解样品。 ①用双氧水和盐酸溶解样品时,发生反应的化学方程式是__ __,此法与硝酸溶解样品相比较,哪种更好? _________为什么?_______________ _______。
②将0.500 g某铜合金样品溶解后,加热煮沸至无气体产生为止,冷却至室温,加入足量的已经酸化的KI溶液,发生如下反应:2Cu2++4I-===2CuI+I2。完全反应后,设法除去CuI,再用0.120 mol·L-1的Na2S2O3溶液滴定(I2+2S2O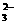 ===2I-+S4O
===2I-+S4O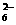 ),消耗了35.5 mL Na2S2O3溶液。则这种铜合金中Cu的质量分数是(实验时采取了适当措施使合金中的其他金属对测定无影响)___________________________
______。
),消耗了35.5 mL Na2S2O3溶液。则这种铜合金中Cu的质量分数是(实验时采取了适当措施使合金中的其他金属对测定无影响)___________________________
______。
(2)在室温下,向100
mL饱和Cu(IO3)2溶液中加入足量的已经酸化的KI溶液,发生如下反应:5I-+IO3+6H+===3I2+3H2O,2Cu2++4I-===2CuI+I2,完全反应后,设法除去CuI后再用a mol·L-1的Na2S2O3溶液滴定(I2+2S2O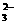 ===2I-+S4O
===2I-+S4O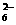 ),消耗了V mL Na2S2O3溶液。则饱和Cu(IO3)2溶液的物质的量浓度是____________________________。
),消耗了V mL Na2S2O3溶液。则饱和Cu(IO3)2溶液的物质的量浓度是____________________________。
24.(8分)今有86 g酒石酸样品,其中混有8 g琥珀酸。现要将该样品用结晶法提纯酒石酸,不同温度下两者溶解度见下表(两者共存时不影响各自的溶解度)。
|
温度(℃) |
20 |
30 |
40 |
50 |
70 |
80 |
|
酒石酸溶解度(g/100 g水) |
18 |
25 |
37 |
65 |
81 |
98 |
|
琥珀酸溶解度(g/100 g水) |
7 |
11 |
16 |
36 |
51 |
71 |
(1)80℃时,溶解该样品,应加__________g水(取10的整数倍)最合适。
(2)将该混合液从80℃冷却到20℃,能否析出纯净的酒石酸晶体?请通过计算说明你得出该结论的理由。
(3)要使混合液尽可能多地析出纯净的酒石酸晶体,冷却温度最低为________℃(取10的整数倍),此温度下能析出酒石酸晶体__________g。
23.(10分)已知:HCN的结构为H-C≡N;

①R-CN RCOOH,
 ②R-Cl+CN-
R-CN+Cl-(R为烃基)。
②R-Cl+CN-
R-CN+Cl-(R为烃基)。
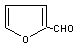 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
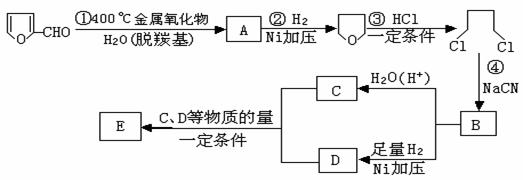
⑴写出反应类型:② ,④ 。
⑵写出反应③的化学方程式: ;
写出能证明糠醛中含有醛基的一个化学反应方程式
。
⑶若E为环状化合物,则其结构简式 。
⑷若E为高聚物,则其结构简式 。
22.(8分)在有机物分子中,不同位置的氢原子的核磁共振谱中给出的峰值(信号)也不同,
根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:
CH3-CH2-O-CH2-CH3其核磁共振谱中给出的峰值(信号)有两个,如图所示:

(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是 。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如下图所示,A的结构简式为 ,请预测B的核磁共振氢谱上有 个峰(信号)
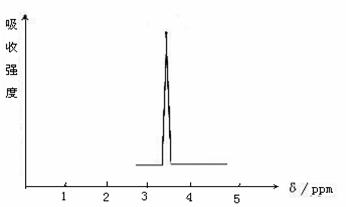

(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是 。
21.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
20.(10分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。

请按要求回答:
(1)写出C的电子式 ,I的化学式 ;
(2)反应③的化学方程式为 ;
(3)反应④的离子方程式为 ;
(4)由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
19.(8分)(1)负离子发生器产生的负离子是O2-,它在大气中存在的时间很短。O2、O3、O2- 三种微粒自身所具能量由高到低的顺序是_____________。
(2)某无色溶液中加入一定量盐酸出现了白色浑浊,试推测可能的离子(要求所写的离子是原子团,且一个是阳离子、另一个是阴离子;写出2种)_________、__________ 。
(3)以A、B两根石墨棒作电极,电解硝酸银溶液,通电10分钟时,在B极收集到气体11.2毫升(标况);然后将电源反接,以相同的电流强度再通电5分钟,此时与第一次通电前相比较,两极的质量变化分别是A极__________、 B极________(填“增大”、“减少”、“不变”);若溶液的体积为200毫升(设体积不变),则溶液的pH值为_______。
18.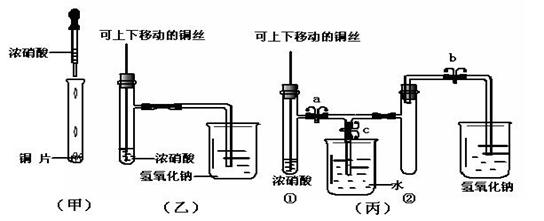 (10分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(10分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
(1)甲、乙、丙三个装置中共同发生的离子反应方程式是 。
(2)和甲装置相比,乙装置的优点是 。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹 ,再打开弹簧夹 ,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作 。
(5)当②试管中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。(不考虑NO2与N2O4的转化且该实验条件下气体摩尔体积设为Vm L/mol)
17.(12分)CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。以下是用铜粉氧化法生产CuO的流程图:
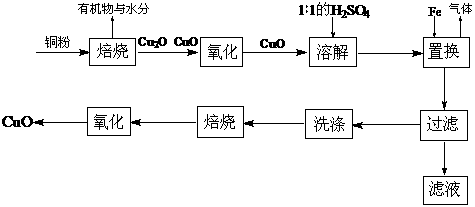
回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98% H2SO4与1体积水混合而成。配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是_________(写分子式),应加以回收处理。
(4)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。假设焙烧后固体只含铜的氧化物,为检验该固体的成分,下列实验设计合理的是____________(选填序号)。
(a)加入稀H2SO4,若溶液呈现蓝色,说明固体中一定有CuO
(b)加入稀H2SO4,若有红色沉淀物,说明固体中一定有Cu2O
(c)加入稀HNO3,若有无色气体(随即变成红棕色)产生,说明固体中有Cu2O
(d)加入稀HNO3,若全部溶解,说明固体中没有Cu2O
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和_____________________(用文字表示)。
16.已知还原性Fe>Cu>Fe2+。现将一定量的m g铁粉加入到某x mol FeCl3和y mol CuCl2的混合溶液中,所得固体质量仍为m g。则x与y的比值可能为
A.2∶7 B. 3∶5 C. 1∶4 D .4∶3
第Ⅱ卷(非选择题 共86分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com